Abordaje
Se debe evaluar a las niñas que presenten signos tempranos de pubertad antes de los 8 años y los niños que presenten signos tempranos de pubertad antes de los 9 años. El médico que los examine debe estar bien informado sobre las etapas de la pubertad normal para saber a quién examinar y tratar. Se debe realizar una anamnesis clínica y una exploración clínica minuciosas. La estatura exacta, la etapa puberal y la edad ósea deben registrarse. El seguimiento de la velocidad de crecimiento en estatura y progreso puberal es lo más importante para diferenciar varias etiologías y decidir las necesidades de intervención terapéutica. Muchos de los pacientes no requieren una investigación muy extensa; sin embargo, siempre es necesario considerar y descartar cualquier causa maligna subyacente, como un tumor.
Antecedentes
La evaluación debe incluir inicialmente una historia detallada del inicio de los caracteres sexuales secundarios, la tasa de avance puberal y, en las niñas, el inicio de la menarquia. Se deben obtener antecedentes detallados del crecimiento reciente y si el niño sobrepasa tallas con mucha rapidez. Deben obtenerse la estatura y la edad de los padres al inicio de la pubertad y de la menarquia en la madre. Los antecedentes sociales deben incluir información sobre adopción.[35][36] El maltrato infantil, particularmente el abuso sexual, es un factor de riesgo para el desarrollo puberal precoz.[37] La historia farmacoterapéutica completa debe registrarse para descartar la ingesta de medicamentos exógenos.[22] Los antecedentes deben considerarse según la consonancia o la disonancia de la pubertad (es decir, si el patrón de cambio endocrino es el mismo que en una pubertad normal, o no).
Desarrollo puberal normal
El desarrollo puberal y su progreso se evalúan mejor con los estadios de Tanner.[1][2]
El primer signo de pubertad en los niños es el aumento en el tamaño de los testículos. Esto es seguido por cambios en el pene y el escroto. El tamaño testicular se documenta a través de la medición del eje más largo o por el volumen testicular utilizando el orquidómetro de Prader. Un volumen de 4 ml o una longitud de 2.5 cm definen el inicio de la pubertad. La presencia de vello axilar y otros cambios, como el de la voz y un aumento en la velocidad de crecimiento únicamente ocurren en las etapas media y final de la pubertad. El vello facial no aparece hasta la etapa final de la pubertad.
[Figure caption and citation for the preceding image starts]: Orquidómetro de PraderCreado por BMJ Knowledge Centre [Citation ends].
 [Figure caption and citation for the preceding image starts]: Método para comparar el tamaño testicular utilizando el orquidómetro de PraderDe la colección del Dr. A. Mehta [Citation ends].
[Figure caption and citation for the preceding image starts]: Método para comparar el tamaño testicular utilizando el orquidómetro de PraderDe la colección del Dr. A. Mehta [Citation ends].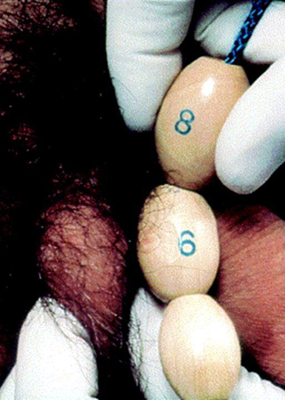
El primer signo demostrable de pubertad en las niñas es el desarrollo mamario. Se debe tener precaución en el examen del tejido mamario en niñas obesas, ya que la grasa simple puede confundirse con tejido mamario. Con un verdadero desarrollo mamario, debe palparse un pequeño botón mamario detrás del pezón. El vello púbico y axilar, el acné y el olor corporal se desarrollan como resultado de los andrógenos secretados por la glándula suprarrenal. La velocidad máxima de crecimiento se produce en el estadio 3 de Tanner y la menarquia suele tener lugar en el estadio 4 de Tanner.
[Figure caption and citation for the preceding image starts]: Etapas de Tanner: A, estándares de evaluación genital en niños; B, estándares de evaluación del vello púbico en niños; C, estándares de evaluación de los senos en niñas; D, estándares de evaluación del vello púbico en niñasAdaptado de Marshall WA, Tanner JM. Arch Dis Child. 1970;45:13-23; Marshall WA, Tanner JM. Arch Dis Child. 1969;44:291-303 [Citation ends].

Pubertad precoz consonante o central (PPC)
El desarrollo puberal consonante sugiere una causa de origen central. El eje hipotalámico-hipofisario-gonadal se activa prematuramente. En las mujeres, la PPC es típicamente idiopática (97% de los casos en niñas de 6-8 años y 75% en niñas <6 años) y un diagnóstico de exclusión.[23] Sin embargo, se debe excluir y buscar activamente cualquier causa subyacente en las pacientes de pocos años. En los hombres, debe buscarse una causa subyacente, ya que sólo alrededor del 60% de los casos se clasifican como idiopáticos.[24][25][26]
Los tumores que pueden producir PPC incluyen los gliomas óptico e hipotalámico, los astrocitomas, los ependimomas y los tumores pineales, y muy raramente tumores endocrinos primitivos, como el craneofaringioma. Los hamartomas del tuber cinereum son tumores congénitos compuestos por una masa heterotópica de neuronas neurosecretoras de hormonas liberadoras de gonadotropina (GnRH), haces de fibras y neurogliocitos, que están frecuentemente asociados a la PPC, a menudo antes de los 3 años de edad.[46] Están asociados frecuentemente con epilepsia gelástica que se presenta con episodios de risa nerviosa y con retraso en el desarrollo.
La hidrocefalia, las lesiones en la cabeza, las infecciones previas como meningitis o encefalitis y la neurofibromatosis también están asociadas con la PPC. Por lo tanto, deben buscarse todos los antecedentes relacionados con estas afecciones.
La historia clínica puede indicar cirugía (debido a un tumor) o radioterapia en el cerebro. La prevalencia de la PPC aumenta después de irradiación craneal para tratar tumores locales o leucemia. Las dosis moderadas de radiación usadas en el tratamiento de tumores cerebrales en niños, y no las dosis bajas o altas, se asocian con pubertad precoz, con una relación directa entre la edad de inicio de la pubertad y la terapia.[29] Las dosis más altas están generalmente asociadas con deficiencia de gonadotropina y un retraso en la pubertad.
Pubertad precoz disonante o gonadotropina-independiente (PPGI)
El desarrollo puberal disconsonante sugiere una causa periférica, lo que significa que la secreción de esteroides sexuales es autónoma e independiente del generador de impulsos de GnRH hipotalámico. Los niños presentan una mayor virilización (desarrollo de pene y escroto), pero con testículos inadecuadamente pequeños. Las niñas pueden presentar un crecimiento avanzado de vello púbico y axilar antes del desarrollo mamario.
Puede haber antecedentes de hiperplasia suprarrenal congénita (HSC) desde el nacimiento o con diagnóstico tardío. El niño ya puede estar en terapia con hidrocortisona y/o fludrocortisona. Los niños con HSC por déficit de 21-hidroxilasa pueden presentar PPGI si son infratratados durante períodos prolongados. Las niñas con HSC por déficit de 21-hidroxilasa presentan signos de virilización (p. ej., vellos púbicos y axilares, clitoromegalia) debido al exceso de andrógenos, aunque no presentan desarrollo mamario.
La testotoxicosis (también llamada PPGI masculina) está asociada con una cantidad de mutaciones constitutivamente activadoras del receptor de la hormona luteinizante (LH).[43][44] También está asociada a la madurez prematura de las células de Leydig y de las células germinativas. El trastorno se hereda como una afección autosómica dominante que se manifiesta solamente en varones. Los antecedentes familiares pueden ser útiles para identificar pacientes afectados.
Es posible que existan antecedentes de deformidades óseas o de glándulas endocrinas hiperfuncionantes debido al síndrome de McCune-Albright (SMA). Esta es una enfermedad multisistémica, caracterizada por la tríada clásica de PPGI con máculas hiperpigmentadas de bordes irregulares o manchas café con leche y un trastorno óseo lentamente progresivo (displasia fibrosa poliostótica).[47][48][49] Los síntomas de otras afectaciones endocrinas incluyen tirotoxicosis (hiperplasia nodular tiroidea), síndrome de Cushing (nódulos hiperplásicos suprarrenales múltiples), gigantismo o acromegalia (adenoma hipofisario y exceso de hormona del crecimiento [GH]) y galactorrea (debido a la hiperprolactinemia). La precocidad sexual es raro en niños de sexo masculino con síndrome de McCune-Albright (SMA).
La exposición prolongada a esteroides sexuales en la PPGI tiene un efecto madurativo directo en el hipotálamo y puede acelerar el inicio de una pubertad central o una pubertad dependiente de la hormona liberadora de gonadotropina (PPC).
Exploración física
Se deben registrar la estatura y el peso actuales y previos de manera precisa. Es obligatorio realizar mediciones precisas y utilizar curvas de crecimiento correctas específicas del sexo y de la edad. Se debe tener cuidado para trazar la estatura y el peso según la edad cronológica real del niño. El crecimiento se relaciona fuertemente con el potencial genético. La estatura objetivo o estatura parental media se calcula de la siguiente manera:
Niña = ([altura de la madre en cm + altura del padre en cm]/2) - 7 cm.
Niño = ([altura de la madre en cm + altura del padre en cm]/2) + 7 cm.
La velocidad de crecimiento determina el cambio en la estatura con el paso del tiempo. Se calcula como la diferencia de estatura en dos mediciones diferentes anualizadas durante un año. Una estatura que se sitúa sistemáticamente en un percentil determinado de la tabla de crecimiento refleja una velocidad de crecimiento normal. El entrecruzamiento de percentiles en dirección ascendente refleja una velocidad de crecimiento acelerada.
Los pacientes con PPC presentan un examen puberal acorde con el desarrollo puberal normal. En los niños de sexo masculino con pubertad precoz independiente de gonadotropinas (PPGI), se produce virilización debido a concentraciones elevadas de testosterona. Sin embargo, el crecimiento de los testículos está ausente o se presenta únicamente en las etapas temprana y media de la pubertad y es menor que lo esperado en relación con la etapa de crecimiento del pene. Los testículos presentan un aumento modesto pero simétrico en la testotoxicosis mientras que asimétrico en los tumores de células de Leydig. En las mujeres, puede haber poco o ningún desarrollo mamario a pesar de la presencia de vello púbico o axilar y/o menstruación.
La presencia de rasgos dismórficos puede revelar síndromes multisistémicos, como anormalidades faciales de la línea media en holoprosencefalia y en displasia septoóptica. Se puede observar asimetría facial en el síndrome de McCune-Albright (SMA).
Un examen de la piel debe permitir identificar la presencia de manchas color café con leche en la neurofibromatosis (bordes regulares) y en el SMA (bordes irregulares). En la neurofibromatosis tipo 1 (NF1) puede haber también otra afectación cutánea en forma de neurofibromas plexiformes, o pecas axilares o intertriginosas.
Un examen detallado de los ojos debe realizarse siempre, que incluya la evaluación del campo visual y fundoscopía. Las alteraciones visuales incluyen nódulos de Lisch en la neurofibromatosis tipo 1 y otros déficits visuales debido a lesión cerebral, tumores o infecciones, así como hipoplasia del nervio óptico en displasia septoóptica. Se pueden presentar déficits motores focales debido a tumores intracraneales, una lesión previa en la cabeza, hidrocefalia, meningitis o encefalitis.[Figure caption and citation for the preceding image starts]: Varón con desarrollo puberal consonanteDe la colección del Dr. A. Mehta; usado con autorización [Citation ends].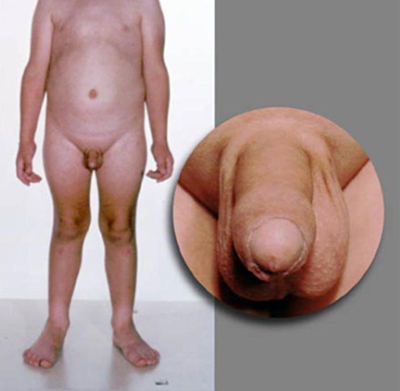 [Figure caption and citation for the preceding image starts]: Varón con hiperplasia suprarrenal congénita (HSC) y desarrollo puberal disonanteDe la colección del Dr. A. Mehta; usado con autorización [Citation ends].
[Figure caption and citation for the preceding image starts]: Varón con hiperplasia suprarrenal congénita (HSC) y desarrollo puberal disonanteDe la colección del Dr. A. Mehta; usado con autorización [Citation ends].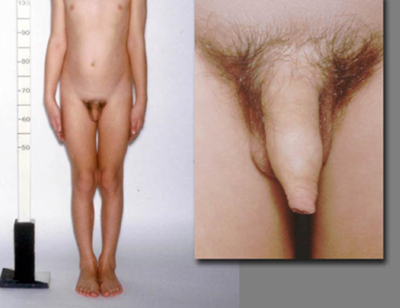 [Figure caption and citation for the preceding image starts]: Niña con pubertad precoz independiente de gonadotropinas (PPGI) y máculas hiperpigmentadas de color café como parte del síndrome de McCune-Albright (SMA)De la colección del Dr. A. Mehta; usado con autorización [Citation ends].
[Figure caption and citation for the preceding image starts]: Niña con pubertad precoz independiente de gonadotropinas (PPGI) y máculas hiperpigmentadas de color café como parte del síndrome de McCune-Albright (SMA)De la colección del Dr. A. Mehta; usado con autorización [Citation ends].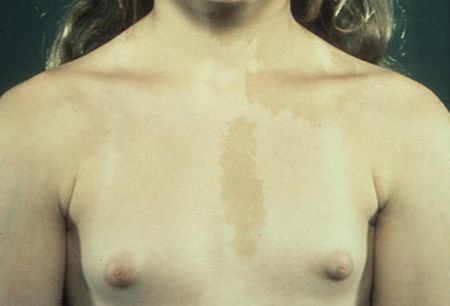 [Figure caption and citation for the preceding image starts]: Pecas axilares en neurofibromatosis tipo 1De la colección del Dr. A. Mehta; usado con autorización [Citation ends].
[Figure caption and citation for the preceding image starts]: Pecas axilares en neurofibromatosis tipo 1De la colección del Dr. A. Mehta; usado con autorización [Citation ends].
Pruebas iniciales
La pubertad precoz idiopática representa la mayoría de los casos en niñas, pero pocos casos en niños, y es un diagnóstico de exclusión. Las investigaciones iniciales deben incluir los siguientes elementos.
Una radiografía de mano/muñeca no dominante (generalmente la izquierda) para calcular la edad ósea. La aparición de centros epifisarios representativos en la radiografía se compara con los estándares publicados adecuados para la edad y el sexo. El método más utilizado es el de Greulich y Pyle o un informe automatizado de edad ósea como BoneXpert.[50] En pacientes con pubertad precoz la edad ósea está generalmente avanzada en 1 a 3 años. La edad ósea puede también ayudar a pronosticar el rango estimado de estatura en adultos y su relación con la estatura parental media; hay que ser cautos con la interpretación, ya que los estándares actuales han sido validados solo en niños normales y no en niños con pubertad precoz (PP).
El diagnóstico bioquímico de la PPC se basa en las concentraciones séricas de gonadotrofinas en la pubertad, ya sea como niveles basales o tras estimulación. Antes del inicio de la pubertad, la hormona foliculoestimulante (FSH) suele ser la gonadotrofina predominante, mientras que durante y después de la pubertad las concentraciones de hormona luteinizante (LH) son superiores a las de FSH. La concentración basal de LH es mucho más sensible que la de FSH. En los casos de PPC, la concentración basal de LH suele ser ≥0.3 UI/L. Una LH basal elevada tiene una alta sensibilidad y especificidad para el diagnóstico de pubertad precoz en hombres, pero es menos sensible en mujeres. Así pues, en las niñas, la medición basal de la LH puede ser adecuada para confirmar, pero no para refutar, el diagnóstico de PPC.[40]
La prueba de GnRH se utiliza en casos menos claros. Para ello, se miden los niveles de LH y FSH en la línea de base y, de nuevo, a los 20 y 60 minutos de la administración de GnRH. Se considera una respuesta puberal con una concentración sérica de LH tras la estimulación de ≥5 UI/L.[51] También se han utilizado análogos de la GnRH para investigar las concentraciones máximas de LH y FSH tras la estimulación si no se dispone de GnRH recombinante.[52]
Las medidas elevadas de estrógenos y testosterona en niñas y niños respectivamente ayudan a confirmar el inicio de la pubertad.
Una ecografía pélvica puede ayudar a diagnosticar la pubertad precoz en las niñas. El útero puede tener una forma y un tamaño pre, peri o postpuberal en función de la fase de la pubertad. Un eco endometrial refleja un efecto estrogénico, mientras que la presencia de folículos en los ovarios refleja la estimulación por gonadotrofinas. El engrosamiento endometrial sugiere que las concentraciones puberales de estrógenos se han alcanzado, y un endometrio de aproximadamente 6 a 8 mm implica una menarquia inminente. La precocidad sexual en niñas con síndrome de McCune-Albright (SMA) es resultado de la función autónoma de múltiples quistes foliculares luteinizados de los ovarios u ocasionalmente un quiste solitario de grande dimensión. Una ecografía pélvica también ayudará a identificar los tumores gonadales secretores de estrógenos.
Pruebas posteriores
Las investigaciones adicionales y el manejo dependen de los síntomas, del patrón de desarrollo sexual, del sexo y de los resultados de la medición de gonadotropina.
PPC
La imagen por resonancia magnética (IRM) del cerebro ayuda a identificar tumores, hidrocefalia, anomalías estructurales hipotalámico-hipofisarias y defectos en la línea media del cerebro. La apariencia característica de un hamartoma es la de una masa sésil o pedunculada, generalmente adherida al hipotálamo posterior, entre el tuber cinereum y los cuerpos mamilares.[53] Existe consenso sobre la necesidad de realizar una IRM cerebral a todos los niños y una IRM cerebral a las niñas con inicio de la pubertad antes de los 6 años, pero los estudios han revelado que el riesgo de encontrar un tumor u otra lesión grave es muy bajo (<1%) en las niñas con inicio de la pubertad entre los 6 y los 8 años, por lo que muchos aconsejan no realizar imágenes de rutina a estas niñas.[54]
La presencia de PPC en ciertas circunstancias, como después de cirugía para un craneofaringioma, después de radioterapia, o en pacientes con displasia septoóptica y holoprosencefalia, justifica una evaluación completa de la hormona hipofisaria para buscar anomalías (frecuentemente déficits) de otras hormonas hipofisarias anteriores y posteriores.
La toma de muestras de gonadotropina durante la noche puede mostrar su pulsatilidad. Se realiza principalmente en un entorno de investigación.
Pubertad precoz gonadotropina-independiente (PPGI)
La 17-hidroxiprogesterona (17-OHP) sérica y otros andrógenos (androstenediona, sulfato de deshidroepiandrostenediona [DHEAS]) son útiles para diagnosticar HSC por déficit de 21-hidroxilasa u otros tipos de HSC. Un perfil de esteroides en orina y una prueba de estimulación con hormona adrenocorticotrófica (ACTH) pueden ayudar a identificar defectos en la síntesis de esteroides suprarrenales.
Si se sospecha la presencia de un tumor suprarrenal en pacientes con virilización, se debe realizar una exploración por tomografía computarizada (TC) de las glándulas suprarrenales. La exploración de las glándulas suprarrenales por medio de ultrasonido tiene un uso limitado.
En el síndrome de McCune-Albright, dependiendo de la sintomatología, otras investigaciones pueden incluir una imagen por resonancia magnética (IRM) de las glándulas suprarrenales para buscar múltiples nódulos hiperplásicos que causen el síndrome de Cushing, una gammagrafía tiroidea para buscar hiperplasia nodular que se presente con tirotoxicosis, o una IRM cerebral si existe gigantismo o galactorrea para descartar adenoma hipofisario. También está indicado realizar una gammagrafía ósea y un examen del esqueleto para identificar lesiones óseas causadas por displasia fibrosa poliostótica.
Otras pruebas que pueden ser consideradas:
Pruebas genéticas deben realizarse en pacientes en los que se sospecha la presencia de neurofibromatosis tipo 1, síndrome McCune-Albright (SMA) o testotoxicosis hereditaria. Las mutaciones de pérdida de función en MKRN3 o DLK1, o las mutaciones de ganancia de función en KISS1R, un receptor acoplado a proteína G que es un ligando para la kisspeptina, pueden causar PPC.[31]
Pruebas de función tiroidea (PFT) para descartar hipotiroidismo primario, una causa poco frecuente de la pubertad precoz. Esto es principalmente útil cuando los síntomas sugieren hipotiroidismo y donde la velocidad de crecimiento disminuye en lugar de aumentar.[Figure caption and citation for the preceding image starts]: Investigaciones en pacientes con pubertad precozDe la colección del Dr. A. Mehta; usado con autorización [Citation ends].

El uso de este contenido está sujeto a nuestra cláusula de exención de responsabilidad