Abordagem
Uma vez identificada, são necessárias avaliações laboratoriais e de imagens mais detalhadas para identificar a etiologia e a patologia adrenal subjacente ao tumor. É importante determinar se o tumor é hormonalmente ativo ou inativo, maligno ou benigno.[25]
Os estudos bioquímicos incluem uma avaliação hormonal padrão: cortisol salivar noturno ou teste de supressão noturna com 1 mg de dexametasona para síndrome de Cushing, metanefrinas fracionadas séricas para feocromocitoma e razão da concentração plasmática de aldosterona/atividade de renina plasmática na presença de hipertensão ou hipocalemia para hiperaldosteronismo primário.[26]
Avaliação clínica
Pacientes com massa adrenal incidental podem apresentar somente características clínicas sutis de excesso de hormônio adrenal ou a massa adrenal pode ser hormonalmente inativa. Sendo assim, a avaliação clínica inicial se concentra na avaliação de sinais e sintomas clínicos das síndromes de superprodução hormonal.[5]
Síndrome de Cushing: ganho de peso, obesidade central, arredondamento da face, pletora, coxins gordurosos supraclaviculares, coxim gorduroso dorsocervical, hematomas frequentes, estrias roxas, fraqueza proximal, alterações do humor, infecções, menstruação irregular, acne, hirsutismo, hipertensão (se houver tumor virilizante ou feminilizante: hirsutismo, amenorreia ou mudança na libido, ginecomastia). Os indivíduos com secreção de cortisol autônomo leve (SCAL), ou síndrome de Cushing subclínica, podem estar assintomáticos, ou os pacientes podem apresentar alterações metabólicas, como intolerância à glicose, diabetes mellitus, hipertensão ou doença metabólica óssea sem outros sinais clínicos.[5][11][27]
Feocromocitoma: hipertensão grave ou episódica, palpitações, palidez, retinopatia, tremor, febre.
Hiperaldosteronismo primário: hipertensão, cãibra/fraqueza muscular, arritmia cardíaca, diabetes insípido nefrogênico induzido por hipocalemia (poliúria, desidratação).
Pacientes com carcinoma adrenal cortical podem apresentar evidência clínica de:
Efeito de massa (por exemplo, dor abdominal)
Hipersecreção adrenal de cortisol (síndrome de Cushing), androgênios (hirsutismo, acne, amenorreia ou oligomenorreia), estrogênios (ginecomastia) ou, muito raramente, aldosterona (sintomas relacionados à hipocalemia).
Avaliação laboratorial
Todos os pacientes devem passar pela investigação a seguir.[5][9][21]
Eletrólitos: hipocalemia pode sugerir hiperaldosteronismo; uma hipocalemia pode estar presente na síndrome de Cushing.
Perfil lipídico em jejum: uma hiperlipidemia pode estar presente na síndrome de Cushing.
Glicemia de jejum: uma hiperglicemia pode estar presente na síndrome de Cushing ou no feocromocitoma.
Hemograma completo: uma leucocitose com neutrofilia pode ocorrer na síndrome de Cushing.
Exame de rastreamento para síndrome de Cushing com cortisol salivar noturno ou teste de supressão noturna com dexametasona (1 mg).[26][27]
Rastreamento para feocromocitoma com metanefrinas fracionadas séricas.
Pacientes com hipertensão também devem ter a razão renina/aldosterona plasmática medida para avaliar o hiperaldosteronismo.
Se o rastreamento da atividade hormonal for positivo, exames adicionais são indicados para confirmar a autonomia hormonal:
Para a síndrome de Cushing, cortisol livre urinário de 24 horas e corticotrofina sérica (hormônio adrenocorticotrófico [ACTH]) de manhã cedo (9h).[26][27]
Para feocromocitoma, metanefrinas urinárias totais de 24 horas e catecolaminas fracionadas.
Para o hiperaldosteronismo, a concentração plasmática de aldosterona com uma dieta sem restrição de sal, excreção urinária de aldosterona de 24 horas e o teste de infusão de soro fisiológico (teste de supressão com soro fisiológico).
Os níveis sanguíneos de androgênios (testosterona e sulfato de desidroepiandrosterona) ou estrogênios (estradiol) não são rotineiros, mas medidos quando houver sinais ou sintomas de virilização nas mulheres ou de feminização nos homens.
A amostra adrenal venosa confirma que a massa adrenal (e não hiperplasia adrenal bilateral) é a fonte do excesso de aldosterona em pacientes com aldosteronismo primário.[5]
As diretrizes europeias sugerem o rastreamento de todos os pacientes com SCAL para hipertensão, diabetes mellitus do tipo 2 e fraturas vertebrais assintomáticas no contexto da osteoporose não tratada.[9]
Exames por imagem
[Figure caption and citation for the preceding image starts]: Investigação de massa adrenal descoberta incidentalmente no exame por imagem [Abreviações: TC: tomografia computadorizada; CECT: TC com contraste; RNM: ressonância nuclear magnética; RNM-CS: RNM por compressed sensing; F-DOPA: 3,4-di-hidroxi-6-(18)F-flúor-l-fenilalanina; FDG: flúor-18-2-deoxiglicose; Ga/Cu DOTATATE: ⁶⁸Ga- ou ⁶⁴Cu-DOTA-(Tyr3)-octreotato; BAAF: biópsia por aspiração com agulha fina (AAF); UH: unidade de Hounsfield; MIBG: metaiodobenzilguanidina; NP-59: iodo-131-6-beta-iodometilnorcolesterol (ou norcolesterol marcado com radioiodo); PET: tomografia por emissão de pósitrons; SUVmáx: valor máximo padronizado de captação; US: ultrassonografia]Adaptado por Dr Ka Kit Wong de Mayo-Smith WW et al. J Am Coll Radiol. 2017 Aug;14(8):1038-44; usado com permissão [Citation ends].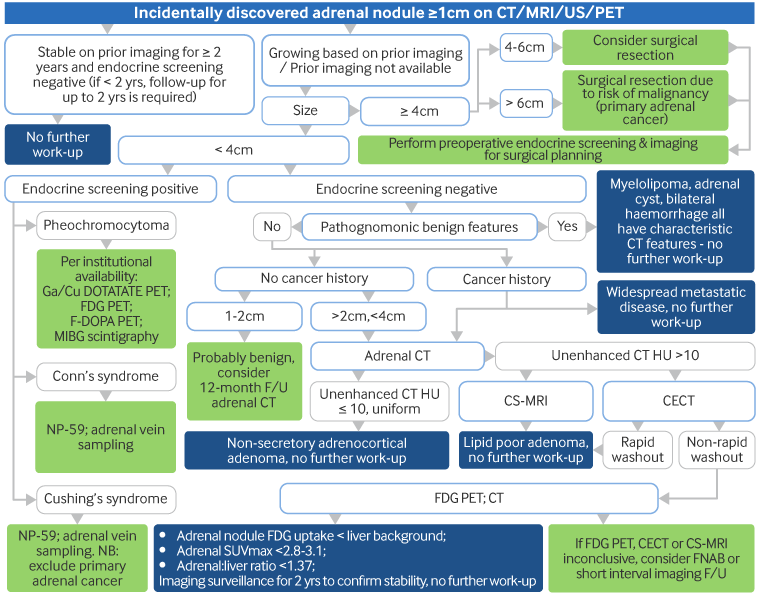
Incidentalomas adrenais podem ser detectados nas investigações abdominais por tomografia computadorizada (TC), ressonância nuclear magnética (RNM), tomografia por emissão de pósitrons (PET) ou ultrassonografia (US) de distúrbios não adrenais.
Se houver um exame por imagem prévio disponível, a confirmação da estabilidade do tamanho durante um período de mais de 2 anos é altamente preditiva de etiologia benigna. O tamanho de uma massa adrenal deve ser considerado, pois quanto maior a massa, maior a probabilidade de ser maligna. No entanto, isso não deve ser usado isoladamente, pois tumores malignos <3 cm de diâmetro não são incomuns. Quanto menor o carcinoma adrenal no momento do diagnóstico, menor o estádio tumoral e melhor o prognóstico geral do paciente. Além disso, a maioria das massas adrenais >4 cm são benignas. O critério do diâmetro >4 cm tem 90% de sensibilidade, mas somente 24% de especificidade para a detecção de carcinoma adrenocortical.[5] Foram propostos limites no tamanho para intervenção cirúrgica; tamanho >6 cm é associado a um aumento do risco de carcinoma adrenocortical e requer ressecção cirúrgica.[28] As diretrizes recomendaram ressecção cirúrgica dos nódulos adrenais com características de TC indeterminadas e tamanho >4 ou 5 cm decorrentes do aumento do risco de neoplasia maligna, ainda que haja controvérsias.[21][25]
As modalidades de imagem podem diferenciar ainda mais as massas adrenais.
Tomografia computadorizada (TC) ou ressonância nuclear magnética (RNM): para avaliar o tamanho e as características morfológicas das lesões adrenais.[Figure caption and citation for the preceding image starts]: Massa adrenal direita de 1.8 cm de diâmetro, descoberta incidentalmente, em um homem de 37 anos de idade. A tomografia computadorizada (TC) abdominal (A) revela massa pobre em lipídio com captação atípica de contraste; cintilografia com norcolesterol marcado com radioiodo (NP-59) feita sem supressão com dexametasona; (B) demonstra um padrão concordante de imagem com acúmulo de iodocolesterol na adrenal direita > esquerda no quinto e sexto dias após a injeção, compatível com uma etiologia benignaDeGroot LJ, Jameson JL, eds. Endocrinology, 5th ed. Philadelphia, PA: Elsevier; 2006. usada com permissão [Citation ends].
As decisões em relação à cirurgia devem levar em consideração não apenas o tamanho, mas também o fenótipo da imagem da massa, assim como a idade do paciente e as afecções coexistentes.[9][21][28]
Na TC sem contraste, os adenomas adrenais benignos (adenomas ricos em lipídio) normalmente têm características de atenuação ≤10 unidades de Hounsfield.[29] Se a lesão adrenal tiver >10 unidades de Hounsfield, o diagnóstico é duvidoso (pode representar um adenoma pobre em lipídio, carcinoma adrenocortical, metástase adrenal ou feocromocitoma). Nesse caso, uma TC com contraste é realizada para avaliar o washout do contraste inicial na lesão; adenomas adrenais mostram ≥60% de washout do contraste em 15 minutos (sensibilidade 88%, especificidade 96% para o diagnóstico de lesão adrenal benigna).
RNM por deslocamento químico é indicada se o incidentaloma adrenal for descoberto durante o estudo da RNM ou se a massa adrenal for indeterminada na TC com contraste e for necessária caracterização adicional. A RNM pode confirmar o conteúdo gorduroso em adenomas ricos em lipídios com alta especificidade.[30]
Exames funcionais por imagem
Realizados principalmente em pacientes com evidência bioquímica de hipersecreção adrenal, cortical e medular para ajudar o planejamento cirúrgico.
Em pacientes com evidências bioquímicas de síndromes endócrinas hipersecretoras e achados indeterminados de TC ou RNM, a imagem funcional com radionuclídeos permite uma caracterização adicional da massa adrenal.
Imagem cortical: cintilografia com norcolesterol marcado com radioiodo (NP-59)
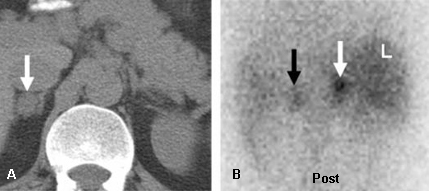
Em pacientes com evidência laboratorial de hipercortisolismo ou hiperaldosteronismo e sem história de câncer, o exame de imagem funcional com radionuclídeos deve começar pela cintilografia por NP-59. Nesse grupo, a captação unilateral na cintilografia por NP-59 por uma massa adrenal virtualmente descarta malignidade adrenal decorrente de câncer adrenocortical primário ou doença metastática. Também pode determinar a lateralidade da função excessiva.[31][Figure caption and citation for the preceding image starts]: Aldosteronoma adrenal esquerdo mostrado com cintilografia com norcolesterol marcado com radioiodo (NP-59) em supressão com dexametasona: mulher de 57 anos com evidências bioquímicas de hiperaldosteronismo e massa adrenal esquerda. A tomografia computadorizada (TC) abdominal (A) demonstra uma massa adrenal esquerda de 2 cm (seta preta), cintilografia com NP-59 abdominal anterior e posterior (B e C) no terceiro dia após a injeção; cintilografia com NP-59 abdominal anterior e posterior (D e E) no quinto dia após a injeção; a captação anormal da adrenal esquerda (setas pretas) ocorre precocemente, antes do dia 5 após a injeção (B e C); captação normal no fígado (L), intestino (B) e vesícula biliar (GB)Rubello D, Bui C, Casara D, et al., Eur J Endocrinol. 2002 Jul;147(1):13-28; usado com permissão [Citation ends].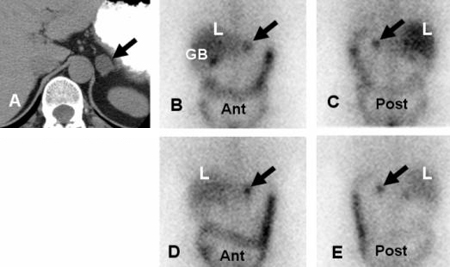
Exame de imagem molecular direcionado envolvendo inibidores de 11β-hidroxilase, inclusive ¹¹C-etomidato e ¹¹C-, ¹⁸F- e ¹²⁴I-metomidato, é uma área nova. Além disso, exame de imagem direcionado para receptor 4 de quimiocinas com ⁶⁸Ga-Pentixafor também foi explorado, e estudos iniciais envolvendo indivíduos com neoplasias hematológicas sugerem sucesso.[32] Esforços para melhorar NP-59 com PET com radioisótopo 18F-NP-59 (FNP-59) também são uma área em desenvolvimento.
Imagem medular: cintilografia com metaiodobenzilguanidina (MIBG)
Um exame com MIBG pode ser usado para avaliar feocromocitoma.
A cintilografia com I-123 ou I-131 metaiodobenzilguanidina (MIBG) identifica tumores de origem cromafim (tumores da medula adrenal e da crista neural). Este teste é utilizado para localização das fontes de hipercatecolaminemia (feocromocitomas intra-adrenais/extra-adrenais/metastáticos/familiares) e outras neoplasias neuro-endócrinas (neuroblastomas e paragangliomas). É indicado quando a TC ou a RNM for indeterminada para feocromocitoma. Uma metanálise mostrou que a MIBG tem sensibilidade de 94% e especificidade de 92% para feocromocitomas.[33] Em pacientes com exame positivo e doença metastática, a terapia com MIBG (iobenguano I-131) pode ser uma opção. Se o exame de MIBG for negativo, deve ser seguido de uma PET com flúor-18-2-deoxiglicose ou um exame de DOTATATE. Uma nova área no exame de imagem adrenomedular envolve melhorar a cintilografia com I-123-MIBG usando um radiotraçador de PET. O exame de imagem com 18F-meta-fluorobenzilguanidina foi bem-sucedido em ensaios iniciais em pacientes com tumores neuroendócrinos.[34] Outro traçador, 3-[18F]fluoro-para-hidroxifenetilguanidina, mostrou resultados promissores para a visualização de feocromocitoma metastático funcional e não funcional e paraganglioma.[35]
[Figure caption and citation for the preceding image starts]: Cintilografia com metaiodobenzilguanidina (MIBG) demonstrando atividade do traçador intensamente focal na glândula adrenal esquerda consistente com feocromocitoma em uma mulher de 56 anos com hipertensão, níveis plasmáticos elevados de noradrenalina e uma massa adrenal esquerda de 3 cm observada na imagem anatômica transversalAvram A, Fig LM, Gross MD. Semin Nucl Med. 2006 Jul;36(3):212-27; usado com permissão [Citation ends].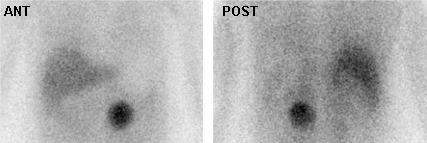 [Figure caption and citation for the preceding image starts]: Feocromocitoma metastático maligno demonstrado por 123-I-metaiodobenzilguanidina (MIBG) e tomografia computadorizada (TC) em uma mulher de 31 anos após adrenalectomia bilateral e hipertensão persistente, complicada por insuficiência renal e desenvolvimento recente de obstrução na veia cava superior (VCS); (A) TC anterior do tórax e abdome. L = captação normal do fígado enquanto a seta mostra múltiplos focos anormais de 123-1-MIBG nos depósitos metastáticos do feocromocitoma nas regiões do mediastino e para-aórtica; (B) TC do tórax identifica a massa mediastinal superior responsável pela obstrução da VCS (seta branca)Rubello D, Bui C, Casara D, et al. Eur J Endocrinol. 2002 Jul;147(1):13-28; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Feocromocitoma metastático maligno demonstrado por 123-I-metaiodobenzilguanidina (MIBG) e tomografia computadorizada (TC) em uma mulher de 31 anos após adrenalectomia bilateral e hipertensão persistente, complicada por insuficiência renal e desenvolvimento recente de obstrução na veia cava superior (VCS); (A) TC anterior do tórax e abdome. L = captação normal do fígado enquanto a seta mostra múltiplos focos anormais de 123-1-MIBG nos depósitos metastáticos do feocromocitoma nas regiões do mediastino e para-aórtica; (B) TC do tórax identifica a massa mediastinal superior responsável pela obstrução da VCS (seta branca)Rubello D, Bui C, Casara D, et al. Eur J Endocrinol. 2002 Jul;147(1):13-28; usado com permissão [Citation ends].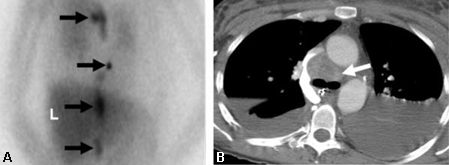
⁶⁸Ga-DOTA-(Tyr3)-octreotato (DOTATATE) PET
O exame de imagem de expressão de somatostatina usando DOTATATE pode ser um agente alternativo eficaz para obter imagens de neoplasias simpatomedualres ou tumores neuroendócrinos. Um pequeno estudo de coorte sugere que DOTATATE pode oferecer imagens de melhor qualidade e sensibilidade, em comparação com MIBG.[36] Também pode ser eficaz para obter imagens de feocromocitomas que têm taxas mínimas ou moderadas de glicólise elevada, o que pode tornar a imagem com FDG desafiadora. De maneira similar à MIBG, se for observada uma captação significativa, a radioterapia terapêutica com lutécio Lu 177 dotatate pode ser usada em pacientes com doença metastática.
Tomografia por emissão de pósitrons (PET) com flúor-18-2-deoxiglicose (FDG)
Em pacientes com história de neoplasia maligna, uma PET-CT com 18-FDG deve ser realizada inicialmente e, se negativa, pode ser seguida de exames com NP-59, MIBG ou DOTATATE.[25][37]
A PET com 18-FDG é útil para a caracterização metabólica das lesões adrenais (benignas versus malignas), o que pode ajudar a determinar se a ressecção cirúrgica é justificada pela suspeita de neoplasia maligna.[38] A PET com 18-FDG ou PET/CT é usada nos pacientes com história de neoplasia maligna, e pode ser considerada nos pacientes cuja TC ou RNM tiver sido inconclusiva.[25]
Em grupos de pacientes com e sem história de câncer, PET com 18-FDG mostrou sensibilidade entre 74% e 100% e especificidade entre 66% e 100% para caracterizar massas benignas versus malignas.[39] Resultados falso-negativos ocorrem devido ao tamanho pequeno, tumores com baixa avidez por FDG (por exemplo, câncer de células renais), necrose e quimioterapia prévia. Falso-positivos ocorrem devido à sobreposição da atividade metabólica com o adenoma adrenocortical benigno, feocromocitoma benigno e doenças inflamatórias das adrenais.
Feocromocitomas são tumores metabolicamente ativos e concentram FDG focalmente em aproximadamente 75% dos casos, sendo que a captação de FDG é mais comum em feocromocitomas malignos que em feocromocitomas benignos. Alguns feocromocitomas que concentram pouca MIBG são geralmente bem visualizados com FDG, e a maioria dos feocromocitomas que não acumula FDG é detectada com MIBG; sendo assim, a PET com 18-FDG ou PET/TC é realizada quando a cintilografia com MIBG é negativa.
Pacientes com câncer têm maior probabilidade de ter realizado uma PET/TC com 18-FDG como parte da investigação para estadiamento ou re-estadiamento. Caso contrário, para os pacientes com câncer, se já estiverem presentes metástases disseminadas, investigações adicionais de um nódulo adrenal podem não ser necessárias.
[Figure caption and citation for the preceding image starts]: Tomografia computadorizada por emissão de pósitrons (PET-CT) com flúor-18-2-deoxiglicose (FDG): adenoma adrenal. Homem de 46 anos com carcinoma de células escamosas do pescoço (tumor TxN1) pós-radioterapia por feixe externo; a PET-CT para reestadiamento demonstra nódulo adrenal esquerdo de 3.7 cm, de baixa atenuação, não ávido por fluordesoxiglucose (FDG), consistente com adenoma adrenal; o estudo de tomografia por emissão de pósitrons (PET) com FDG excluiu metástase à distância da glândula adrenalGross MD, Avram A, Fig LM, et al. Eur J Nucl Med Mol Imaging. 2007 Apr;34(4):547-57; usado com permissão [Citation ends].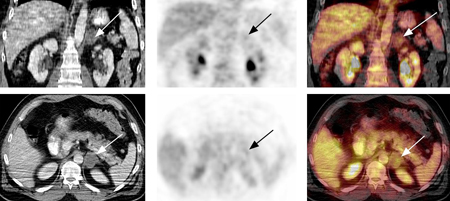
PET com flúor-18 di-hidroxifenilalanina (18F-DOPA)
Realizada quando MIBG e PET com 18 são negativas, mas há evidências bioquímicas persistentes de feocromocitoma (por exemplo, metanefrinas fracionadas séricas elevadas).
biópsia por aspiração com agulha fina (AAF) guiada por TC
Realizada para a avaliação diagnóstica das massas adrenais em pacientes com história de câncer (principalmente de pulmão, mama e renal) e sem outras metástases, para diferenciar o tecido adrenal do não adrenal (por exemplo, metástases ou infecção).
O feocromocitoma deve sempre ser excluído antes do procedimento para evitar crise hipertensiva.
A biópsia por AAF guiada por TC não é realizada rotineiramente devido ao risco de:
complicações relacionadas ao procedimento (2.8%, incluindo dor abdominal, hematoma adrenal, hematúria, pancreatite, pneumotórax, formação de abscesso adrenal)
risco de metástase no trajeto da agulha (0.3% dos pacientes com acompanhamento de longo prazo) e
alta taxa de resultados falso-negativos.
Geralmente, a biópsia por AAF não é realizada para confirmar a suspeita de carcinoma adrenocortical devido ao risco relacionado à disseminação de células neoplásicas ao longo do trajeto da agulha. Se houver grande suspeita, a ressecção cirúrgica é indicada.
A biópsia por AAF não é geralmente realizada para comprovar suspeita de doença granulomatosa, ainda que seja uma causa conhecida de resultados falso-positivos de PET com 18-FDG.
A biópsia por AAF pode ser necessária para o diagnóstico de massas/nódulos adrenais ainda indeterminados quanto à malignidade após a avaliação por imagem.
Se a amostragem tecidual não for indicada, uma estratégia de acompanhamento por imagem em intervalos curtos (de 6 a 12 meses) pode ser realizada.
Outros testes
A amostragem da veia adrenal também pode ser utilizada para lateralização dos nódulos adrenais secretores de cortisol ou de aldosterona.
Acompanhamento
Após a avaliação diagnóstica inicial, o acompanhamento dos incidentalomas adrenais >1 cm inclui uma avaliação por imagem em 6 a 12 meses para avaliar o aumento da massa. Geralmente, as lesões que permanecerem estáveis por 2 anos ou mais podem ser consideradas benignas; não é necessário acompanhamento radiológico adicional.[25] Exames bioquímicos anuais (teste de supressão noturna com 1 mg de dexametasona e metanefrinas fracionadas séricas) são realizados anualmente durante 4 anos para descartar o aparecimento de hipersecreção hormonal subclínica.[1]
Pacientes com incidentaloma adrenal correm o risco de crescimento do tumor e desenvolvimento de alterações hormonais. Um estudo de acompanhamento em longo prazo (12-120 meses, mediana 25.5 meses) de 64 pacientes com massas adrenais incidentais revelou que o risco cumulativo de evoluir para anormalidades endócrinas era de 17% em 1 ano, 29% em 2 anos e 47% em 5 anos; o risco cumulativo de aumento da massa era de 6% em 1 ano, 14% em 2 anos e 29% em 5 anos.[40] Taxa de crescimento rápida (>2 cm por ano) sugere malignidade agressiva (por exemplo, carcinoma adrenocortical), enquanto estabilidade ou taxa de crescimento lenta (0.5 cm a 1 cm por ano) sugere um processo benigno.[2]
Um acompanhamento adicional pode não ser necessário para tumores adrenais que permanecem estáveis após 2 estudos de imagens realizados com intervalo de no mínimo 6 meses e não exibem hipersecreção hormonal após 4 anos.
O uso deste conteúdo está sujeito ao nosso aviso legal