Abordagem
Introdução
Como resumo inicial, recomendamos os seguintes pontos-chave ao avaliar um paciente com massa tireoidiana:
Confirme se a massa é intratireoidiana ou extratireoidiana. Indícios da anamnese, do exame físico e de exames de imagem (ultrassonografia e/ou tomografia computadorizada [TC]) podem ajudar na diferenciação entre os dois tipos.
A ultrassonografia cervical é o teste inicial de escolha preferencial para avaliar a estrutura e a localização anatômica de uma massa cervical e para avaliar a presença de aspectos que possam aumentar a suspeita clínica sobre a massa.[2][38][33] Ela é custo-efetiva e não expõe o paciente a radiação ionizante.
Os linfonodos cervicais sempre devem ser avaliados por ultrassonografia quando um nódulo tireoidiano estiver sendo avaliado.[1] Se apresentarem sinais de neoplasia maligna (microcalcificações, aspecto cístico, hipervascularização periférica), deve-se realizar punção aspirativa guiada por ultrassonografia.[1]
Se a massa ou o nódulo surgir a partir da glândula tireoide, avalie se há atividade hormonal.[3] A anamnese, o exame físico e as medições pareadas do T4 e do hormônio estimulante da tireoide (TSH) são usados para avaliar o status funcional da lesão.
Massas tireoidianas difusas, não nodulares, podem ser o resultado de uma tireoidite ou linfoma e a avaliação depende da gravidade dos sintomas, da taxa de progressão e da aparência radiográfica da lesão.
Os aspectos da ultrassonografia isoladamente não são suficientes para descartar ou confirmar a malignidade. Para os nódulos tireoidianos que necessitem de diagnóstico definitivo, deve ser realizada a aspiração com agulha fina (AAF) guiada por ultrassonografia quando esse conhecimento for clinicamente impactante. O tratamento subsequente adequado pode ser orientado pelos resultados da citologia. A orientação atual desencoraja a biópsia de rotina para nódulos tireoidianos com menos de 1 cm.[1][2][18]
Deve-se considerar uma lobectomia (hemitireoidectomia) diagnóstica para um diagnóstico histológico definitivo após duas ou mais biópsias com AAF insatisfatórias ou indeterminadas; esses pacientes têm um risco mais elevado de malignidade que a taxa geral para todos os nódulos tireoidianos.[1]
As seguintes seções explicam a abordagem diagnóstica de maneira mais detalhada.
História
A maioria dos nódulos tireoidianos é assintomática. No entanto, o paciente deve ser avaliado pelos sintomas de hipotireoidismo ou hipertireoidismo e pelos sintomas compressivos locais como disfonia, disfagia e dispneia.
Os sintomas de hipertireoidismo incluem irritabilidade, aumento da transpiração, intolerância ao calor, palpitações, tremores, ansiedade, insônia, cabelos finos e quebradiços, movimentos intestinais frequentes e perda de peso. Os sintomas de hipotireoidismo incluem intolerância ao frio, constipação, ganho de peso, fadiga e pele seca e pruriginosa.
Os fatores que aumentam a probabilidade de malignidade incluem:[39]
Sexo masculino
Idade na apresentação <20 anos ou >60 anos
História de crescimento rápido
Irradiação prévia da cabeça e do pescoço (terapêutica, industrial/ocupacional ou de liberação ambiental devido a um acidente nuclear)
Disfonia/rouquidão
História familiar de carcinoma medular de tireoide, outro câncer de tireoide, neoplasia endócrina múltipla ou síndrome de Cowden.
Exame físico
O exame físico envolve a realização de uma avaliação detalhada da massa tireoidiana e de qualquer linfadenopatia associada, avaliando se o paciente apresenta sinais de hipotireoidismo ou hipertireoidismo e se as estruturas circundantes (traqueia e esôfago) estão comprimidas.
O exame físico deve incluir a inspeção e a palpação dos aspectos anterior e lateral do pescoço para avaliar o aumento da tireoide, a presença de nódulos e linfadenopatia. Pedir ao paciente para deglutir durante a palpação, que eleva a tireoide, pode melhorar a palpação da glândula tireoide e a detecção de nódulos. Os sinais de hipertireoidismo incluem taquicardia, arritmias, perda de massa muscular, tremor, reflexos rápidos e cabelo quebradiço. Os sinais de hipotireoidismo incluem bradicardia, pele com aspecto espesso e inchado (mixedema) e fase de relaxamento tardia dos reflexos.
A visualização dos movimentos das pregas vocais é muito importante caso o paciente apresente disfonia. Isso pode ser feito com um espelho odontológico e uma lanterna, um exame com ultrassom ou com um nasofaringoscópio flexível (o teste definitivo).[40] Uma prega vocal paralisada ipsilateral à massa tireoidiana é uma preocupação quanto a câncer de tireoide invasivo. As diretrizes atuais da American Academy of Otolaryngology-Head and Neck Surgery recomendam o exame físico da laringe para os pacientes com massa cervical que represente risco aumentado de malignidade.[41] Isso pode envolver o encaminhamento para outro médico que seja capaz de fazer esse exame físico direcionado.
As características físicas de um nódulo da tireoide não são bons preditores de malignidade; no entanto, as seguintes características indicam um risco elevado de malignidade:[39]
Nódulos >4 cm de tamanho
Rigidez na palpação
Fixação do nódulo nos tecidos adjacentes
Linfadenopatia cervical
Paralisia das pregas vocais
Achados do exame físico consistentes com uma história de radiação ionizante no pescoço ou na parte superior do tórax.
[Figure caption and citation for the preceding image starts]: BócioCortesia de Mediscan/Alamy; usado com permissão [Citation ends].
Avaliação laboratorial
Os pacientes que se apresentam com nódulos da tireoide geralmente estão eutireoideos. Isso pode ser confirmado verificando-se o nível sérico de hormônio estimulante da tireoide (TSH).[2][38] Se o TSH estiver abaixo do normal (suprimido), deve ser realizada uma avaliação adicional com tiroxina livre (T4L) e tri-iodotironina (T3L) livre ou calculada para confirmar o hipertireoidismo. Alguns profissionais preferem solicitar o TSH e o T4L em conjunto.
Considere questionar os pacientes sobre a ingestão de biotina (vitamina B7), pois um alto consumo de suplementos alimentares pode levar a resultados falsamente altos ou baixos nos testes da função tireoidiana.[38][42][43]
O hipertireoidismo no caso de nódulos da tireoide pode sugerir a presença de um ou mais adenomas hiperfuncionantes (autônomos) e o risco de malignidade em tais nódulos é muito baixo.[2] Caso a tireoide esteja difusamente aumentada, deve-se suspeitar de doença de Graves ou tireoidite. A captação o escaneamento com iodo radioativo geralmente diferenciam essas condições e devem ser evitados até o teste de tiroxina livre/hormônio estimulante da tireoide (T4L/TSH).[36] Caso o TSH esteja elevado, deve ser realizada uma avaliação adicional com T4L e autoanticorpos (considerando-se a tireoidite de Hashimoto).
Os níveis de cálcio sérico (total e ionizado) e paratormônio intacto podem ser avaliados se as características da imagem do nódulo ou da massa cervical forem sugestivas de uma glândula paratireoide aumentada.[2] Os níveis de calcitonina sérica devem ser obtidos nos pacientes com história familiar de carcinoma medular da tireoide e neoplasia endócrina múltipla tipo II. No entanto, não é recomendada a verificação da calcitonina na avaliação de rotina dos nódulos da tireoide.[1][34][44]
Ultrassonografia
A ultrassonografia cervical é o estudo de imagem inicial de escolha para os nódulos da tireoide, bem como de muitas outras lesões anatômicas no pescoço.[33] A ultrassonografia pode detectar e caracterizar nódulos pequenos demais para serem palpáveis, e fornecer dimensões exatas para facilitar o monitoramento seriado.[2] A ultrassonografia é amplamente utilizada na avaliação de linfadenopatia central ou lateral do pescoço.[2][34]
Frequentemente, a inflamação (por exemplo, tireoidite subaguda, tireoidite de Hashimoto e tireoidite crônica) pode causar ecotextura heterogênea da glândula tireoide que pode, em conjunto com uma linfadenopatia associada, ser sugestiva do diagnóstico. A inflamação também pode causar a formação de pseudonódulos, que são áreas indistintamente demarcadas que surgem devido a heterogeneidade focal, mas que não são verdadeiras lesões nodulares. Essas lesões desaparecem na ultrassonografia quando o transdutor é virado 90 graus para onde o pseudonódulo tiver sido visualizado Os pseudonódulos não necessitam de aspiração com agulha fina (AAF) e, no cenário de tireoidite, devem ser acompanhados de forma expectante para se observar se regridem, uma vez remitida a tireoidite.
O tamanho e o aspecto sonográfico do nódulo determinam a necessidade de uma avaliação adicional com AAF.[35][45] A malignidade não pode ser diagnosticada ou descartada definitivamente com a ultrassonografia. No entanto, a presença dos seguintes aspectos ultrassonográficos observados abaixo deve aumentar o nível de suspeição sobre malignade e a necessidade de biópsia por AAF:[45]
Presença de um componente sólido
Microcalcificações
Margens irregulares
Formato mais comprido que largo
Aparência sonográfica hipoecoica em relação ao parênquima tireoidiano
O tamanho limite da AAF depende das características sonográficas, mas geralmente é maior que 1 cm. A biópsia com AAF de nódulos menores deve ser considerada caso haja história de alto risco ou aparência sonográfica suspeita. A observação de algumas dessas lesões pode merecer discussão entre o médico e o paciente em alguns casos.
A biópsia por AAF de nódulos tireoidianos sólidos e palpáveis descobertos incidentalmente, sem história de alto risco das características sonográficas, deve ser considerada se o tamanho for ≥1 cm. Os nódulos císticos e sólidos mistos sem características suspeitas e os nódulos espongiformes ≥2 cm devem ser avaliados com AAF.[1] Um nódulo com biópsia prévia e que tenha aumentado de tamanho >50% em um estudo de acompanhamento também deve ser considerado para uma nova biópsia.[1]
Todos os linfonodos com suspeita de câncer de tireoide localmente metastático devem passar por biópsia se isso puder mudar o plano de tratamento, assim como os linfonodos em um sítio próximo da traqueia ou da artéria carótida que possam apresentar risco de complicações se não forem tratados. Entretanto, em algumas circunstâncias, os linfonodos podem ser apenas observados.
[Figure caption and citation for the preceding image starts]: Características sonográficas e tamanho limite do nódulo para aspiração com agulha fina (AAF).Criado pelo BMJ Knowledge Centre e pelo Dr. BC Stack Jr; adaptado de Haugen BR, Alexander EK et al. Thyroid 2016 Jan;26(1):1-133 [Citation ends].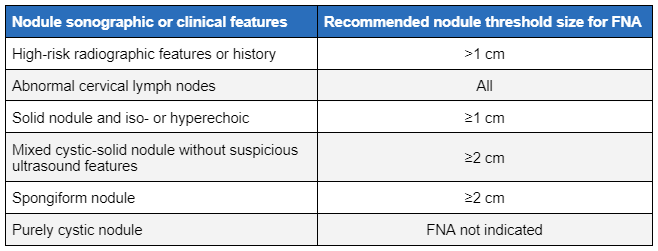 [Figure caption and citation for the preceding image starts]: Imagem de ultrassonografia do nódulo tireoidianoCortesia de Getty images; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Imagem de ultrassonografia do nódulo tireoidianoCortesia de Getty images; usado com permissão [Citation ends]. [Figure caption and citation for the preceding image starts]: Calculadora TI-RADS: gráfico mostrando cinco categorias com base no léxico ACR Thyroid Imaging, Reporting and Data System (TI-RADS), níveis TR e critérios para aspiração com agulha fina ou ultrassonografia de acompanhamentoAdaptado de Tessler FN et al. J Am Coll Radiol 2017 May;14(5):587-95 [Citation ends].
[Figure caption and citation for the preceding image starts]: Calculadora TI-RADS: gráfico mostrando cinco categorias com base no léxico ACR Thyroid Imaging, Reporting and Data System (TI-RADS), níveis TR e critérios para aspiração com agulha fina ou ultrassonografia de acompanhamentoAdaptado de Tessler FN et al. J Am Coll Radiol 2017 May;14(5):587-95 [Citation ends].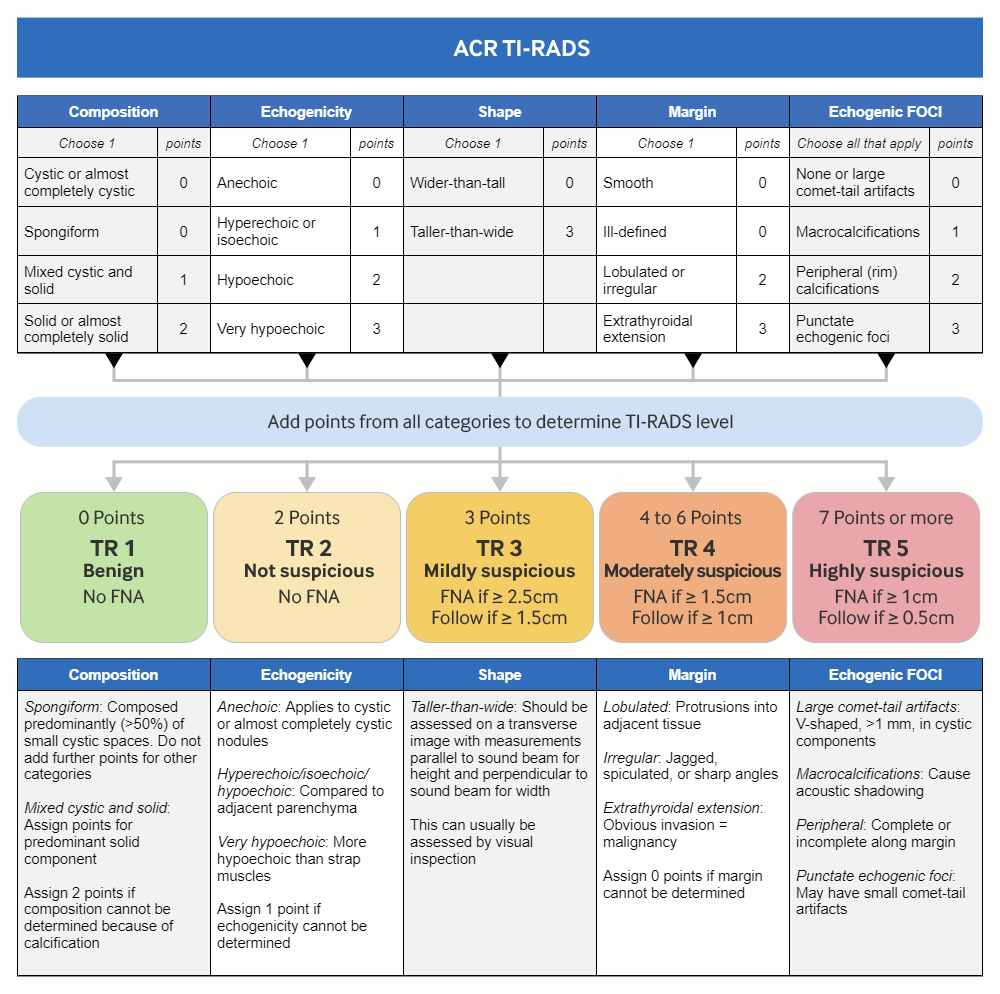
O Thyroid Imaging, Reporting, and Data System do American College of Radiology (ACR TI-RADS) classifica os nódulos com base nas características ultrassonográficas como benignos, minimamente suspeitos, moderadamente suspeitos ou altamente suspeitos para neoplasia maligna. Isso ajuda a orientar a decisão sobre a necessidade de ultrassonografia de acompanhamento ou AAF.[45]
Imagem por radioisótopo
Se o hormônio estimulante da tireoide (TSH) estiver suprimido, deve ser feita imagem por radioisótopo para identificar nódulos autonomamente hiperfuncionantes ('quentes') e para distinguir entre doença de Graves e tireoidite. Um nódulo da tireoide que exibe captação de radioisótopo focalmente aumentada com supressão do parênquima tireoidiano circundante tem risco de malignidade de menos de 2%.[3] Um escaneamento com radioisótopo mostrando tal nódulo 'quente' evidencia a necessidade de se realizar uma aspiração com agulha fina (AAF) se não houver outras características ou história suspeitas.[2] O uso da varredura com radioisótopo para identificação de nódulos 'frios' como um meio de estratificação do risco não é mais recomendado, pois não oferece vantagens adicionais sobre a ultrassonografia e a AAF na diferenciação entre lesões benignas e malignas.[46]
[Figure caption and citation for the preceding image starts]: Exames de captação de iodo: apresentações típicas de ausência de captação na tireoidite (figura superior); captação aumentada difusa na doença de Graves (imagem inferior esquerda); áreas de captação elevada e reduzida em bócio multinodular tóxico (imagem central inferior); área única de captação elevada em um adenoma tóxico (figura inferior direita)Cortesia do Dr. Petros Perros [Citation ends].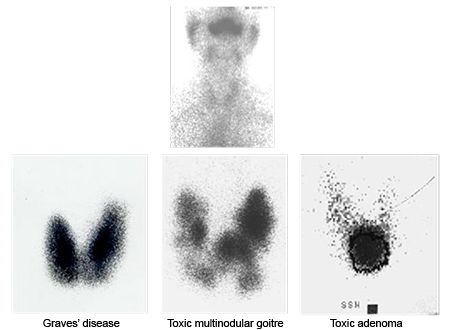
Tomografia computadorizada (TC) e ressonância nuclear magnética (RNM)
Nem a TC nem a RNM (imagem transversal) têm um papel importante na avaliação inicial de um nódulo tireoidiano; contudo, elas podem ser usadas para uma medição e avaliação precisas do tamanho dos bócios subesternais grandes e podem identificar linfonodos que não podem ser visualizados pela ultrassonografia.[2] Elas também são úteis nos casos de bócio grande com extensão posterior e adenopatia volumosa difusa.
A administração de contraste iodado para TC deve ser cuidadosamente considerada, pois ele frequentemente impede um diagnóstico e uso terapêutico subsequentes de iodo radioativo por 4 a 8 semanas ou mais. O contraste iodado também pode induzir o efeito de Jod-Basedow (hipertireoidismo induzido por iodo) e hipertireoidismo exacerbado na presença de doença de Graves subjacente ou adenoma(s) tóxico(s). Se houver preocupação sobre uso terapêutico de iodo radioativo após administração de contraste iodado para tomografia computadorizada (TC), pode ser realizada coleta de urina de 24 horas e medir-se o nível de iodo na urina.
Tomografia por emissão de pósitrons (PET)
A PET com fluordesoxiglucose (FDG-PET) parece ter sensibilidade relativamente alta, mas especificidade baixa para malignidade, sendo que os resultados variam entre os estudos.[47] Logo, a FDG-PET não é recomendada durante a avaliação inicial de um nódulo. No entanto, qualquer nódulo de tireoide ávido por FDG encontrado incidentalmente merece uma avaliação meticulosa para malignidade.[48][49][50] A avaliação deve incluir uma ultrassonografia cervical seguida por aspiração com agulha fina (AAF), se indicada, com base na história do paciente e nas características da imagem do nódulo.[51] A captação homogênea e difusa da PET pela glândula tireoide raramente indica câncer de tireoide: geralmente ela é observada na tireoidite linfocítica crônica (de Hashimoto).[36]
Biópsia por aspiração com agulha fina (AAF)
Depois da ultrassonografia, a aspiração com agulha fina (AAF) guiada por ultrassonografia é o procedimento de escolha para a avaliação de nódulos tireoidianos suspeitos.[34] A citologia e os testes genéticos moleculares adjuvantes podem determinar se a cirurgia é indicada. O procedimento é bem tolerado e apresenta um risco muito baixo de complicações. Dor local e hematoma são as complicações mais comuns, enquanto os eventos adversos mais graves são raros.[52] A AAF possibilita uma melhor precisão diagnóstica, um maior rendimento para neoplasia maligna no momento da cirurgia e uma redução significativa dos custos.[53] O uso de orientação por ultrassonografia para a localização da agulha demonstrou reduzir a taxa de espécimes inadequados comparados com AAF não guiada.[54]
Esfregaços de citologia de alta qualidade são essenciais para o diagnóstico e devem ser tecnicamente adequados com coloide e material celular bem preparados para uma avaliação satisfatória. A citopatologia da AAF é relatada como insatisfatória, benigna, indeterminada, suspeita ou maligna. Aproximadamente 10% a 20% dos resultados da citologia são relatados como insatisfatórios ou inadequados, 60% a 75% são relatados como benignos e 6% a 10% são relatados como suspeitos ou malignos.[55][56] A terminologia exata varia entre os departamentos de patologia. Isso motivou o desenvolvimento do sistema de classificação Bethesda, que é comumente usado, e que foi atualizado em 2017. O sistema de classificação Bethesda inclui as categorias diagnósticas recomendadas, o risco implícito de neoplasia maligna e o manejo clínico recomendado. As categorias são designadas como: não diagnóstico ou insatisfatório; benigno; atipia de significado indeterminado ou lesão folicular de significado indeterminado; neoplasia folicular ou suspeita de neoplasia folicular; suspeita de neoplasia maligna; e maligno.[57] O manejo pode depender de outros fatores (por exemplo, clínico, sonográfico), além da interpretação da aspiração com agulha fina (AAF)[57][58]
Resultados insatisfatórios da citologia requerem a repetição da AAF. Uma segunda tentativa de AAF orientada por ultrassonografia produzirá um espécime diagnóstico satisfatório em até 75% dos nódulos sólidos e 50% dos nódulos císticos.[59] Se os resultados ainda forem insatisfatórios após 2 tentativas, deve-se considerar uma lobectomia diagnóstica (hemitireoidectomia).
Lesões citologicamente benignas não císticas na AAF podem ainda assim apresentar até 5% de risco de malignidade, que pode ser ainda maior em nódulos ≥4 cm (provavelmente por erros de amostragem). Tais nódulos, portanto, ainda requerem um acompanhamento com ultrassonografia cervical e exame cervical anual.[60]
O conteúdo do cisto aspirado geralmente produz resultados citológicos interpretados como inadequados ou indeterminados devido à falta de conteúdo celular e ausência de coloide. A maioria dos nódulos císticos é complexa (sólido-cístico). Os puramente císticos geralmente não necessitam de AAF, a menos que sejam sintomáticos, pois o risco de malignidade é extremamente baixo, mas quando um aspirado citológico insatisfatório ou indeterminado é obtido de um nódulo puramente cístico ele deve ser tratado de forma conservadora e normalmente não é necessária intervenção futura.
Os nódulos com diagnóstico citológico com critérios de Bethesda de células atípicas de significado indeterminado/lesão folicular de significado indeterminado ou equivalente podem ser considerados para repetição da AAF após 4 a 6 semanas para permitir a cura do trato da AAF prévia.[61] Os pacientes com neoplasias foliculares com suspeita de malignidade ou citologia maligna devem ser encaminhados para um cirurgião experiente em endocrinologia ou cabeça e pescoço para tratamento adicional.
Sistemas de classificação também estão disponíveis na American Thyroid Association e na British Thyroid Association e mapeiam-se às categorias de Bethesda.[1][62]
Uso de marcadores moleculares com AAF
Mutações pontuais bem descritas, como BRAF V600E, NRAS61, HRAS61, KRAS12/13 e RET/CTP e rearranjos PAX8/PPARγ, foram associadas ao câncer de tireoide. O uso emergente de testes moleculares para ajudar na interpretação das amostras de AAF demonstrou aumentar a precisão diagnóstica e o rendimento dos resultados da citologia.[63]
Quando disponíveis, os testes moleculares serão especialmente úteis na avaliação dos resultados indeterminados da citologia, onde a presença de uma das mutações ou rearranjos mencionados acima aumenta significativamente a possibilidade de malignidade.[57][64] A presença de um exame molecular positivo pode, portanto, alterar a tomada de decisão clínica favorecendo a tireoidectomia antecipada como a escolha mais adequada para o tratamento cirúrgico inicial. No entanto, como a maioria dos cânceres papilares e foliculares de tireoide contêm uma dessas mutações, a ausência de uma mutação não pode descartar uma neoplasia.[1] Caso o exame molecular não esteja disponível, é necessária uma abordagem diagnóstica padrão geralmente envolvendo lobectomia diagnóstica (hemitireoidectomia) para definir os casos citologicamente ambíguos ou indeterminados.
Diagnóstico cirúrgico
Deve-se considerar uma lobectomia (hemitireoidectomia) diagnóstica para um diagnóstico histológico definitivo após duas ou mais biópsias com AAF insatisfatórias ou indeterminadas; esses pacientes têm um risco mais elevado de malignidade que a taxa geral para todos os nódulos tireoidianos.[1] A tireoidectomia total é recomendada em alguns pacientes com citologia maligna a depender do tamanho da lesão, da presença de linfadenopatia, da necessidade prevista de radioiodo pós-operatório e da presença de outras doenças nodulares coexistentes.[1]
Os nódulos com resultado de citologia indeterminado ou suspeito devem passar por uma avaliação multidisciplinar por um cirurgião e um endocrinologista para determinar os próximos passos ideais.
A cirurgia também é indicada se um nódulo for sintomático devido a compressão das estruturas adjacentes, como a traqueia ou o esôfago. Tomografia computadorizada (TC), ressonância nuclear magnética (RNM) e espirometria loop podem ser métodos adjuvantes úteis para a avaliação do grau de compressão. A remoção dos nódulos de 4 cm ou maiores também é recomendada, pois a taxa de falsos-negativos da AAF para a detecção de malignidade foi relatada como sendo de 13% por erros de amostragem.[65] No entanto, a AAF também pode ser útil na avaliação de nódulos grandes, pois a confirmação por citologia pré-operatória indicando malignidade ou suspeita permitirá o planejamento da extensão ideal da cirurgia.
Todos os pacientes sujeitos a cirurgia de tireoide devem submeter-se a uma avaliação pré-operatória da voz; um exame pré-operatório da laringe é recomendado nos pacientes com anormalidades pré-operatórias na voz.[1][Figure caption and citation for the preceding image starts]: Algoritmo para avaliação da massa tireoidianaCriado pelo BMJ Knowledge Centre e Dr B.C. Stack Jr (AAF, aspiração com agulha fina; PTH, paratormônio; TSH, hormônio estimulante da tireoide) [Citation ends].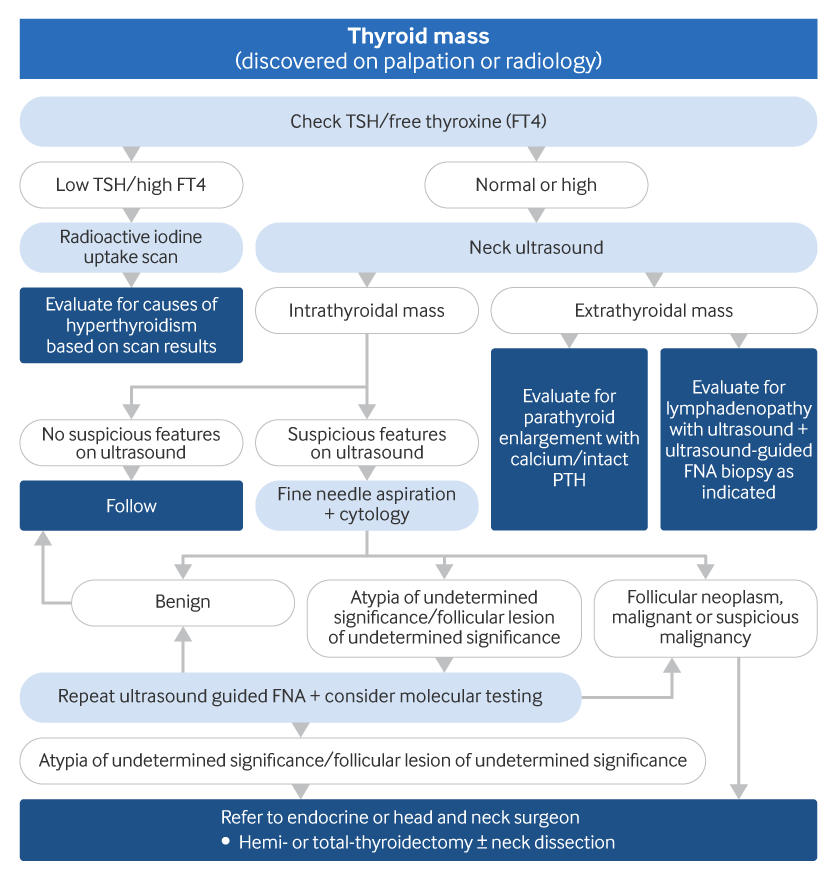
Estratificação de risco
O conceito de estratificação do risco de pacientes com nódulos tireoidianos que termina em um diagnóstico citológico maligno é a chave para entender a abordagem de manejo do câncer de tireoide.[1][18][66] Isso pode ser feito com imagens pré-operatórias ou com dados adicionais da patologia pós-operatória.[45] Este processo serve como uma maneira objetiva de prescrever o nível de vigilância e a extensão da ressecção cirúrgica ou da ablação para pacientes com câncer de tireoide, e foi ilustrado com base em uma escala crescente dos riscos conhecidos.
O uso deste conteúdo está sujeito ao nosso aviso legal