მიდგომა
შესავალი
ფარისებრი ჯირკვლის წარმონაქმნების მქონე პაციენტთა შეფასებისას, საწყისი შეჯამების სახით, ჩვენ რეკომენდაციას გაძლევთ შემდეგ საკვანძო საკითხებზე:
დაადასტურეთ წარმონაქმნი ფარისებრშიდაა თუ ფარისებრგარე. ანამნეზის, გასინჯვის და რადიოლოგიური კვლევის (ულტრაბგერითი და/ან კტ) მონაცემები გვეხმარება ამ ორს შორის დიფერენცირებაში.
კისრის ულტრასონოგრაფია უპირატესი საწყისი კვლევაა კისრის წარმონაქმნის სტრუქტურის და ანატომიური მდებარეობის, ასევე იმ რადიოგრაფიული ნიშნების შესაფასებლად, რამაც შეიძლება გაზარდოს ეჭვი წარმონაქმნის შესახებ.[2][38][33]აღნიშნული კვლევა ხარჯთეფექტურია და პაციენტის დასხივება მაიონიზებელი რადიაციით არ ხდება.
კისრის ლიმფური კვანძები ყოველთვის უნდა გამოვიკვლიოთ ულტრებგერითი კვლევით ფარისებრი ჯირკვლის კვანძის შეფასებისას.[1] თუ აღინიშნება ავთვისებიანობის ნიშნები (მიკროკალციფიკატები, ცისტური განვითარება, პერიფერიული ჰიპერვასკულარიზაცია), უნდა ჩატარდეს ასპირაციული ბიოფსია ულტრაბგერითი კონტროლით.[1]
თუ წარმონაქმნი ან კვანძი ჩნდება ფარისებრი ჯირკვლიდან, შეამოწმეთ არის თუ არა წარმონაქმნი ჰორმონულად აქტიური.[3] ანამნეზი, გასინჯვა, თავისუფალი T4-ისა და თიროიდმასტიმულირებელი ჰორმონის (TSH) დონის განსაზღვრა გამოიყენება დაზიანების ფუნქციური მდგომარეობის შესაფასებლად.
ფარისებრი ჯირკვლის დიფუზური, არაკვანძოვანი წარმონაქმნები შესაძლოა თირეოდიტის ან ლიმფომის შედეგი იყოს. შეფასება დამოკიდებულია სიპტომების სიმძიმეზე, პროგრესირების სიჩქარესა და დაზიანების სონოგრაფიულ სურათზე.
მხოლოდ ულტრაბგერითი ნიშნები არ არის საკმარისი ავთვისებიანი მდგომარეობის გამოსარიცხად ან დასადასტურებლად. ფარისებური ჯირკვლის კვანძების დასკვნით დიაგნოზისთვის აუცილებელია ულტრაბგერით მართული ასპირაციული ბიოფსია, რაც კლინიკურად მნიშვნელოვან ინფორმაციას მოგვცემს. შესაბამისი შემდგომი მკურნალობა შესაძლოა წარიმართოს ციტოლოგიური კვლევის შედეგების მიხედვით. ამჟამინდელი გაიდლაინებით ფარისებრის კვანძების რუტინული ბიოფსია არ არის მოწოდებული 1 სმ-ზე ნაკლები კვანძების შემთხვევაში.[1][2][18]
დიაგნოსტიკური ლობექტომია (ჰემითირეოიდექტომია) უნდა განიხილებოდეს დასკვნითი ჰისტოლოგიური დიაგნოზისთვის, ორი ან მეტი არადამაკმაყოფილებელი ან განუსაზღვრელი წვრილნემსიანი ასპირაციული (FNA) ბიოფსიის შემდეგ; ამ პაციენტებს აქვთ ავთვისებიანი მდგომარეობების განვითარების უფრო მაღალი რისკი, ფარისებრი ჯირკვლის ყველა კვანძის საერთო სიხშირესთან შედარებით.[1]
ჩამოთვლილ სეგმენტებში უფრო დეტალურადაა განხილული დიაგნოსტიკური მიდგომა.
ანამნეზი
ფარისებრი ჯირკვლის კვანძების უმრავლესობა უსიმპტომოა. თუმცა, პაციენტები უნდა გამოვიკვლიოთ ჰიპოთიროიდიზმის ან ჰიპერთიროიდიზმის და ადგილობრივ კომპრესიულ სიმპტომებზე, როგორიცაა დისფონია, დისფაგია და დისპნოე.
ჰიპერთიროიდიზმის სიმპტომები მოიცავს გაღიზიანებადობას, გაძლიერებულ პერსპირაციას, სიცხის აუტანლობას, გულის ფრიალს, ტრემორს, შფოთვას, უძილობას, ნაზ მყიფე თმას, ნაწლავების ხშირ მოქმედებას და წონაში კლებას. ჰიპოთიროიდიზმის სიმპტომები მოიცავს სიცივის აუტანლობას, შეკრულობას, წონაში მატებას, დაღლილობას, მშრალ კანს და კანის ქავილს.
ფაქტორები, რომლებიც ავთვისებიანობის მაღალ მაჩვენებელზე მიუთითებს:[39]
მამრობითი სქესი
ასაკი გამოლინებისას <20 ან >60 წელი
ანამნეზში სწრაფად ზრდა
თავკისრის დასხივება (თერაპიული, ინდუსტრიული/პროფესიული ან გარემოში ბირთვული აფეთქების შემდეგ)
დისფონია/ხმის ჩახლეჩა
ოჯახურ ანამნეზში ფარისებრი ჯირკვლის მედულარული კარცინომა, ფარისებრი ჯირკვლის კიბო, მრავლობითი ენდოკრინული ნეოპლაზია ან ქოვდენის სინდრომი.
ფიზიკური გამოკვლევა
გასინჯვა მოიცავს ფარისებრი ჯირკვლის წარმონაქმნებისა და ნებისმიერი ასოცირებული ლიმფადენოპათიის დეტალურ შეფასებას, ჰიპოთირეოზის ან ჰიპერთირეოზის ნიშნების და მიმდებარე სტრუქტურებზე (ტრაქეასა და საყლაპავ მილზე) ზეწოლის შეფასებას.
გასინჯვა უნდა მოიცავდეს კისრის წინა და ლატერალური მიდამოს ინსპექციას და პალპაციას, ფარისებრი ჯირკვლის გადიდების, კვანძების არსებობის და ლიმფადენოპათიის შესაფასებლად. თუ პაციენტს სთხოვთ, პალპაციის დროს ჩაყლაპოს ნერწყვი (რაც ფარისებრ ჯირკვალს გადაანაცვლებს ზევით), ეს გააუმჯობესებს პალპაციას და დაგეხმარებათ კვანძების გამოვლენაში. ჰიპერთირეოზის ნიშნებია: ტაქიკარდია, არითმია, კუნთების განლევა, ტრემორი, რეფლექსების გაცხოველება და თმების მტვრევადობა. ჰიპოთირეოზის ნიშნებია: ბრადიკარდია, კანის გასქელება და შეშუპება (მიქსედემა) და რეფლექსების რელაქსაციის ფაზის დაყოვნება.
დისფონიის მქონე პაციენტთან ძალიან მნიშვნელოვანია სახმო იოგების მოძრაობის ვიზუალიზაცია. ეს შესაძლოა ჩატარდეს დენტალური სარკით და შუბლის ნათურით, ულტრაბგერითი კვლევით ან დრეკადი ნაზოფარინგოსკოპით (დამდასტურებელი ტესტი)[40]ფარისებრი ჯირკვლის ინვაზიური კიბოს შემთხვევაში სახმო იოგების დამბლა ვლინდება წარმონაქმნის იფსილატერალურად. ამერიკის ოტორინოლარინგოლოგიის აკადემიის თავისა და კისრის ქირურგიის ამჟამინდელი გაიდლაინებით რეკომენდებულია ყელის გასინჯვა კისრის წარმონაქმნის მქონე პაციენტებში, რომლებიც ითვლებიან ავთვისებიანი მდგომარეობების მაღალი რისკის მქონე პირებად.[41] ეს შეიძლება მოიცავდეს გაგზავნას სხვა ექიმთან, რომელსაც შეუძლიდ მიზნობრივი კვლევის ჩატარება.
ფარისებრი ჯირკვლის კვანძის ფიზიკალური მახასიათებლები ავთვისებიანობის სუსტი პროგნოზული ფაქტორებია; თუმცა, ჩამოთვლილი მახასიათებლები მიუთითებს ავთვისებიანობის მაღალ რისკზე:[39]
>4 სმ ზომის კვანძები
სიმკვრივე პალპაციისას
კვანძების ფიქსაცია მიმდებარე ქსოვილებში
კისრის ლიმფადენოპათია
სახმო იოგების დამბლა
ფიბროზის გამოკვლევის შედეგები, რომელიც შეესაბამება ანამნეზში კისრის ან გულმკერდის ზედა ნაწილში მაიონიზებელი დასხივების არსებობას.
[Figure caption and citation for the preceding image starts]: აღენიშნებათ ჩიყვიCourtesy of Mediscan/Alamy: used with permission [Citation ends].
ლაბორატორიული შეფასება
ფარისებრი ჯირკვლის კვანძების მქონე პაციენტებს, ჩვეულებრივ, აქვთ ეუთირეოიდული სტატუსი. აღნიშნულის დადასტურება ხდება შრატში TSH-ის დონის შემოწმებით.[2][38] თუ TSH-ის დონე ნორმაზე დაბალია (დაქვეითებულია), შემდგომ უნდა შემოწმდეს თავისუფალი თიროქსინი (FT4) და გამოთვლილი ან თავისუფალი ტრიიოდთირონინი (FT3), ჰიპერთირეოზის დასადასტურებლად. ზოგიერთი პრაქტიკოსი ექიმი უპირატესობას ანიჭებს TSH და FT4-ის კვლევას (დაწყვილებული ნაკრების სახით).
გაითვალისწინეთ, რომ ჰკითხოთ პაციენტებს მათ მიერ ბიოტინის (ვიტამინ B7-ის) მიღებაზე, რადგან დიეტური დანამატების მზარდმა მოხმარებამ შესაძლოა გამოიწვიოს ფარისებრი ჯირკვლის ფუნქციური ტესტის ცრუ- მაღალი ან -დაბალი შედეგები.[38][42][43]
ჰიპერთირეოზი, ფარისებრი ჯირკვლის კვანძების ფონზე შესაძლოა მიანიშნებდეს ერთ ან მეტ ჰიპერფუნქციურ (ავტონომიურ) ადენომაზე და ასეთი კვანძების ავთვისებიანობის რისკი ძალიან დაბალია.[2] თუ ფარისებრი ჯირკვალი დიფუზურად გადიდებულია, უნდა ვიფიქროთ გრეივსის დაავადებასა ან თირეოიდიტზე. რადიოაქტიული იოდის შთანთქმა და სკანირება როგორც წესი, განასხვავებს ამ ორ მდგომარეობას და არ უნდა ჩატარდეს FT4/TSH -ის შემოწმებამდე.[36]თუ TSH მომატებულია, უნდა ჩატარდეს შემდგომი შეფასება FT4-სა და აუტოანტისხეულებზე (ჰაშიმოტოს თირეოიდიტის გათვალისწინებით).
შესაძლოა შემოწმდეს შრატის კალციუმი (საერთო და იონიზებული) და პარაფარისებრი ჯირკვლის ჰორმონების ინტაქტური, თუ კვანძის ან კისრის წარმონაქმნის რადიოლოგიური მახასიათბელები მიუთითებს პარაფარისებრი ჯირკვლის გადიდებაზე.[2]პაციენტებში, ფარისებრი ჯირკვლის მედულარული კარცინომის და II ტიპის მრავლობითი ენდოკრინული ნეოპლაზიის ანამნეზით, უნდა შემოწმდეს შრატში კალციტონინის დონე. თუმცა ფარისებრი ჯირკვლის კვანძების შეფასებისას კალციტონინის დონის შემოწმება რუტინულად არ არის რეკომენდებული.[1][34][44]
ექოსკოპია
კისრის ექოსკოპია ფარისებრი ჯირკვლის კვანძების, ასევე კისრის ბევრი სხვა ანატომიური დაზიანების, უპირატეს კვლევას წარმოადგენს.[33] ულტრასონოგრაფიით შესაძლებელია პალპაციისთვის ძალიან პატარა კვანძების გამოვლენა და დახასიათება, ზუსტი ზომების მიღება, რათა გაადვილდეს სერიული მონიტორინგი.[2] ულტრასონოგრაფია ფართოდ გამოიყენება კისრის ცენტრალური ან ლატერალური მიდამოს ლიმფადენოპათიის შესაფასებლად.[2][34]
ანთებამ (მაგ., ქვემწვავე თირეოიდიტმა, ჰაშიმოტოს თირეოიდიტმა და ქრონიკულმა თირეოიდიტმა) შეიძლება ხშირად განაპირობოს ფარისებრი ჯირკვლის ჰეტეროგენური ექოსტრუქტურა, რაც ასოცირებულ ლიმპადენოპათიასთან ერთად მიუთითებს დიაგნოზზე. ანთებამ შეიძლება გამოიწვიოს ფსევდოკვანძების ფორმირება, რომლებიც არ არის მკვეთრად შემოსაზღვრული, ჩნდება კეროვანი ჰეტეროგენურობის გამო, მაგრამ არ არის ჭეშმარიტი კვანძოვანი დაზიანება. ულტრაბგერითი გამოკვლევისას ეს დაზიანებები ქრება, როდესაც გადამცემს აყენებენ 90 გრადუსზე, რომელზეც შესაძლებელია ფსევდოკვანძების ვიზუალიზაცია. ფსევდოკვანძები არ საჭიროებს წვრილნემსიან ასპირაციულ (FNA) ბიოფსიას და თირეოიდიტის დროს უნდა დავაკვირდეთ, ხომ არ ხდება მისი რეგრესი თირეოიდიტის უკუგანვითრების შედეგად.
კვანძების ზომა და სონოგრაფიული მახასიათებლები განსაზღვრავს შემდგომი შეფასების საჭიროებას FNA-ით.[35][45] ულტრასონოგრაფიით არ არის შესაძლებელი ავთვისებიანი მდგომარეობის დასკვნითი დიაგნოსტირება ან მისი გამორიცხვა. თუმცა ქვემოთჩამოთვლილი ულტრასონოგრაფიული ნიშნების არსებობამ უნდა გაზარდოს ეჭვი ავთვისებიანობაზე და FNA ბიოფსიის ჩატარების საჭიროებაზე.[45]
სოლიდური კომპონენტის არსებობა
მიკროკალციფიკაციები
უსწორმასწორო კიდეები
უფრო მაღალი ვიდრე ფართო ფორმის
ფარისებრი ჯირკვლის პარენქიმის შესაბამისი ჰიპოექოგენური ულტრაბგერითი სურათი.
წვრილნემსიანი ასპირაციული (FNA) ბიოფსიის ზღვრული ზომა დამოკიდებულია სონოგრაფიულ მახასიათებლებზე, მაგრამ, ჩვეულებრივ აჭარბებს 1 სმ-ს. უფრო პატარა კვანძების FNA ბიოფსია განიხილება, თუ არსებობს მაღალი რისკის ანამნეზი ან საეჭვო სონოგრაფიული სურათი. ამ დაზიანებებიდან ზოგიერთზე დაკვირვებამ შერჩეულ შემთხვევებში შეიძლება ხელი შეუწყოს დისკუსიას ექიმსა და პაციენტს შორის.
პალპირებადი და შემთხვევით აღმოჩენილი მკვრივი ლიმფური კვნაძების (რომლებსაც არ აქვთ მაღალი რისკის ულტრაბგერითი ნიშნები) FNA ბიოფსია უნდა გაკეთდეს, თუ ზომა არის ≥1 სმ. შერეული ცისტური და მკვრივი კვანძები, რომლებსაც საეჭვო ნიშნები არ აქვთ და ≥2 სმ ღრუბლისებრი კვანძები უნდა გამოვიკვლიოთ ასპირაციული ბიოფსიით.[1] კვანძს, რომელსაც ადრე ჩაუტარდა ბიოფსია, მაგრამ დაკვირვების პროცესში >50%-ით გაიზარდა ზომაში, განმეორებითი ბიოფსია უნდა ჩაუტარდეს.[1]
რეკომენდებულია ფარისებრი ჯირკვლის ლოკალურ მეტასტაზური კიბოზე საეჭვო ყველა ლიმფური კვანძის ბიოფსია, თუ ეს შეცვლის მკურნალობის გეგმას. ასევე უნდა ჩატარდეს ტრაქეასა ან საძილე არტერიასთან ახლომდებარე ლიმფური კვანძების ბიოფსია, რადგან არანამკურნალებ შემთხვევაში შესაძლოა არსებობდეს გართულებების რისკი. თუმცა ზოგიერთ შემთხვევაში შეიძლება უბრალოდ დაკვირვება ლიმფურ კვანძებზე.
[Figure caption and citation for the preceding image starts]: კვანძების სონოგრაფიული მახასიათებლები და ზღვრული ზომები წვრილნემსიანი ასპირაციისთვის (FNA).Created by the BMJ Knowledge Centre and Dr B.C. Stack Jr; adapted from Haugen BR, Alexander EK et al. Thyroid 2016 Jan;26(1):1-133 [Citation ends].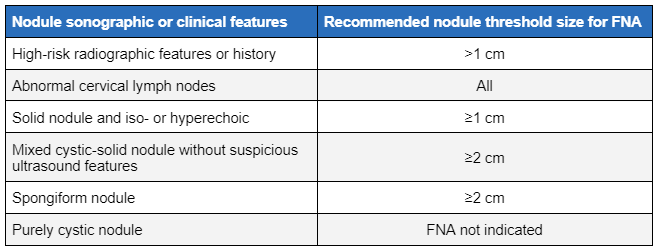 [Figure caption and citation for the preceding image starts]: ფარისებრის კვანძის ულტრაბგერითი სურათიCourtesy of Getty images; used with permission [Citation ends].
[Figure caption and citation for the preceding image starts]: ფარისებრის კვანძის ულტრაბგერითი სურათიCourtesy of Getty images; used with permission [Citation ends]. [Figure caption and citation for the preceding image starts]: TI-RADS კალკულატორი: დიაგრამა გვიჩვენებს ხუთ კატეგორიას, რომელიც ეფუძნება ამერიკის რადიოლოგთა კოლეჯის ფარისებრი ჯირკვლის ვიზუალიზაციის, აღრიცხვისა და მონაცემთა სისტემის (TI-RADS) ლექსიკონს, ტექნოლოგიური მზადყოფნის დონეს და წვრილნემსიან ასპირაციას ან შემდგომ ულტრასონოგრაფიულ მეთვალყურეობას. Adapted from Tessler FN et al. J Am Coll Radiol 2017 May;14(5):587-95 [Citation ends].
[Figure caption and citation for the preceding image starts]: TI-RADS კალკულატორი: დიაგრამა გვიჩვენებს ხუთ კატეგორიას, რომელიც ეფუძნება ამერიკის რადიოლოგთა კოლეჯის ფარისებრი ჯირკვლის ვიზუალიზაციის, აღრიცხვისა და მონაცემთა სისტემის (TI-RADS) ლექსიკონს, ტექნოლოგიური მზადყოფნის დონეს და წვრილნემსიან ასპირაციას ან შემდგომ ულტრასონოგრაფიულ მეთვალყურეობას. Adapted from Tessler FN et al. J Am Coll Radiol 2017 May;14(5):587-95 [Citation ends].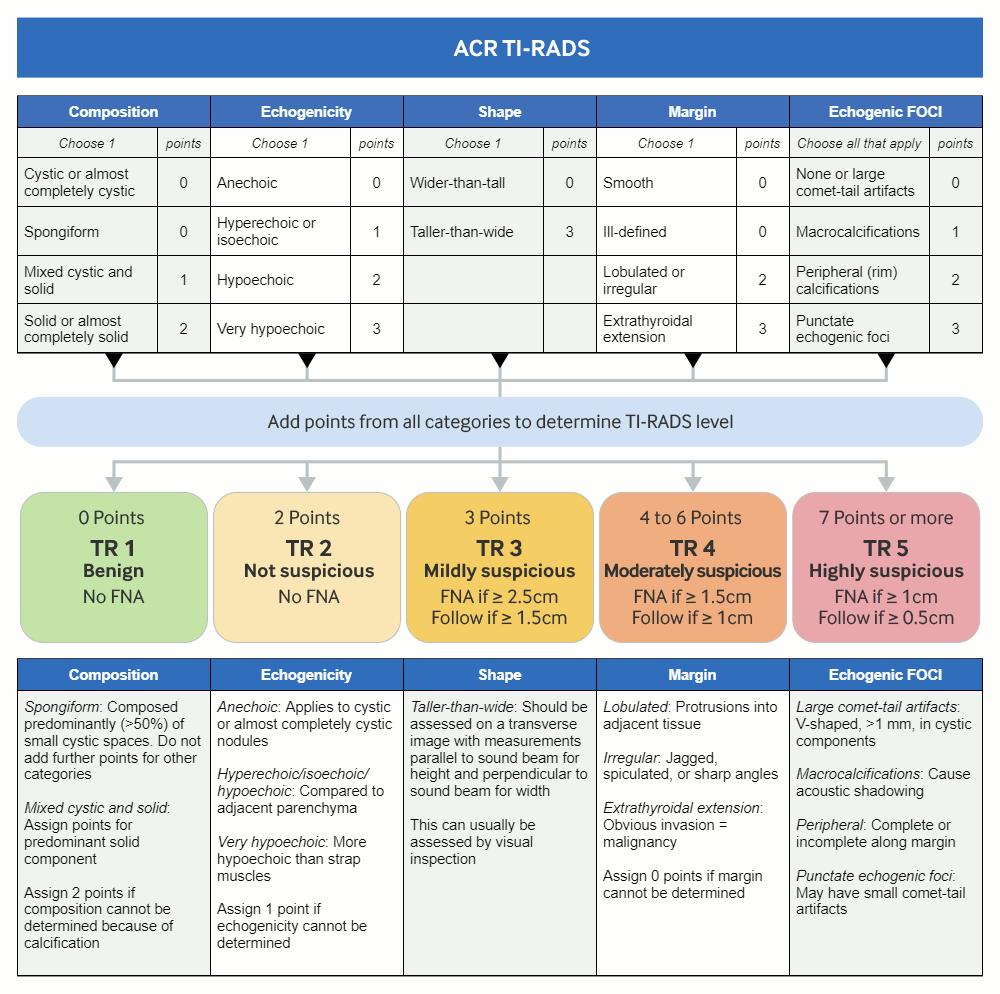
ამერიკის რადიოლოგთა კოლეჯის (ACR) ფარისებრი ჯირკვლის ვიზუალიზაციის, აღრიცხვისა და მონაცემთა სისტემის (TI-RADS) ლექსიკონში ულტრაბგერითი მახასიათებლები ავთვისებიანი მგომარეობებისთვის კატეგორიზებულია როგორც კეთილთვისებიანი, მინიმალურად საეჭვო, ზომიერად საეჭვო ან ძალიან საეჭვო. აღნიშნული გვეხმარება შემდგომი ულტრაბგერითი მეთვალყურეობის ან წვრილნემსიანი ასპირაციული (FNA) ბიოფსიის ჩატარების საჭიროებაში.[45]
რადიოიზოტოპური გამოსახულება
თუ TSH-ის დონე დაქვეითებულია, უნდა ჩატარდეს რადიოიზოტოპური ვიზუალიზაცია ავტონომიურად ჰიპერფუნქციური ("ცხელი") კვანძების იდენტიფიცირების და გრეივსის დაავადებისა და თირეოიდიტის დიფერენცირებისთვის. ფარისებრი ჯირკვლის კვანძს, რომელიც გაძლიერებულად შთანთქავს რადიოიზოტოპს, მიმდებარე თიროიდული პარენქიმის ზეწოლასთან ერთად, ავთვისებიანობის რისკი აქვს 2%-ზე ნაკლები.[3] რადიოიზოტოპური სკანირება, რომელიც აჩვენებს "ცხელ" კვანძს, სხვა საეჭვო ნიშნების ან ანამნეზის არარსებობისას, გამორიცხავს წვრილნემსიანი ასპირაციული (FNA) ბიოფსიის ჩატარების საჭიროებას.[2] რადიოიზოტოპური სკანირების გამოყენება "ცივი" კვანძების იდენტიფიკაციისთვის, როგორც რისკის სტრატიფიკაციის საშუალება, აღარ არის რეკომენდებული. მას არ აქვს დამატებითი უპირატესობა ულტრასონოგრაფიასა და წვრილნემსიან ასპირაციულ (FNA) ბიოფსიასთან შედარებით, ავთვისებიან და კეთილთვისებიან დაზიანებებს შორის დიფერენცირებისთვის.[46]
[Figure caption and citation for the preceding image starts]: იოდის ათვისების სკანირება: თირეოიდიტის დროს არათვისების ტიპიური გამოვლინება (ზედა პანელი); გრეივსის დაავადების დროს დიფუზური გაძლიერებული ათვისება (ქვედა მარცხენა პანელი); ტოქსიკური მრავალკვანძოვანი ჩიყვის არეში მომატებული და შემცირებული ათვისება (ქვედა შუა პანელი); ტოქსიკური ადენომის დროს ათვისების ერთი ადგილი (ქვედა მარჯვენა პანელი)Courtesy of Dr Petros Perros [Citation ends].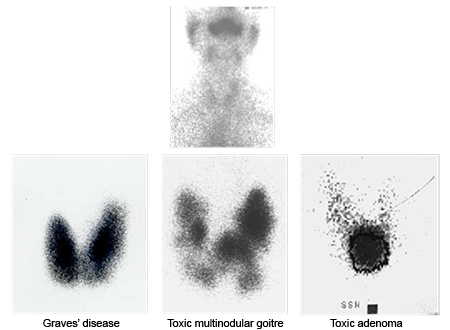
კომპიუტერული ტომოგრაფია (კტ) და მაგნიტურ-რეზონანსული კვლევა (MRI)
არც კტ და არც MRI-ს (ჯვარედინი კვლევა) არ აქვს პირველადი როლი ფარისებრი ჯირკვლის კვანძების კვლევისას; თუმცა, ისინი შესაძლოა გაყენებულ იქნას დიდი მკერდუკანა ჩიყვების ზუსტი გაზმოვებისა და შეფასებითვის და მათ მეშვეობით შესაძლებელია იმ ლიმფური კვანძების აღმოცენა, რომლებიც არ ცანს ულტრაბგერითი კვლევისას.[2] ისინი ასევე გვეხმარება დიდი ჩიყვების შემთხვევებში, რომლებიც ვრცელდება უკან და თან ახლავს დიფუზური მასიური ადენოპათია.
იოდინირებული საკონტრასტო ნივთიერება სიფრთხილით უნდა გამოვიყენოთ კტ სკანირების დროს, ვინაიდან ის ხელს უშლის შემდგომში რადიოაქტიური იოდის დიაგნოსტიკურ და სამკურნალო გამოყენებას 4-8 კვირის ან უფრო მეტი ხნის განმავლობაში. სკანირება იოდინირებული საკონტრასტო ნივთიერებით ასევე იწვევს ჯოდ-ბაზედოვის ეფექტს (იოდით გამოწვეული ჰიპერთიროიდიზმი) და ამწვავებს ჰიპერთიროიდიზმს გრეივსის დაავადების ან ტოქსიკური ადენომ(ებ)ის არსებობისას. თუ გათვალისწინებულია რადიოაქტიური იოდის სამკურნალოდ გამოყენება, იოდინირებული კონტრასტის შეყვანის შემდგომ უნდა შეგროვდეს 24 სთ-იანი შარდი და გაიზომოს იოდი.
პოზიტრონულ-ემისიური ტომოგრაფია (PET)
ფთორდეზოქსიგლუკოზა (FDG)-PET სკანირებას ავთვისებიანი მდგომარეობებისთვის აქვს შედარებით მაღალი სენსიტიურობა, მაგრამ დაბალი სპეციფიკურობა და შედეგებიც განსხვავდება.[47] ამგვარად, FDG-PET არ არის რეკომენდირებული კვანძის საწყისი კვლევისას. თუმცა, ნებისმიერი შემთხვევით აღმოჩენილი FDG-სწრაფვის ფარისებრი ჯირკვლის კვანძი საჭიროებს სერიოზულ კვლევას ავთვისებიანობაზე.[48][49][50] შეფასება უნდა მოიცავდეს კისრის ულტრასონოგრაფიას, რასაც მოჰყვება წვრილნემსიანი ასპირაციული (FNA) ბიოფსია (ჩვენების მიხედვით), პაციენტის ანამნეზისა და კვანძის ვიზუალიზაციური მახასიათებლების საფუძველზე.[51] პოზიტრონულ-ემისიურ ტომოგრაფიაზე (PET) ფარისებრი ჯირკვლის მიერ ჰომოგენური დიფუზური შთანთქმა იშვიათად მიუთითებს ფარისებრი ჯირკვლის კიბოზე: ის ჩვეულებრივ გვხვდება ქრონიკული ლიმფოციტური (ჰაშიმოტოს) თირეოდიტის დროს.[36]
წვრილნემსიანი ასპირაციული (FNA) ბიოფსია
ულტრაბგერითი კვლევის შემდგომ ულტრებგერით მართული ასპრაციული ბიოფსია საეჭვო კვანძების კვლევის უპირატესი პროცედურაა.[34] ციტოლოგიური და დამატებით მოლეკულური გენეტიკური კვლევით შესაძლებელია დადგინდეს ქირურგიული ჩარევის ჩვენების საჭიროება. პროცედურას ადვილად იტანენ პაციენტები და გართულებების რისკი ძალიან დაბალია. ყველაზე ხშირი გართულებებია ლოკალური ტკივილი და ჰემატომა. არასასურველი მოვლენები იშვიათია.[52] წვრილნემსიანი ასპირაციული (FNA) ბიოფსია აუმჯობესებს ზუსტ დიაგნოსტიკას, იძლევა კარგ გამოსავალს ქირურგიული ჩარევის დროს და მნიშვნელოვნად ხარჯთეფექტიანია.[53] ულტრაბგერის გამოყენება ნემსის მდებარეობის დასადგენად ამცირებს არადეკვატური ნიმუშების აღებას არამართულ ასპირაციულ ბიოფსიებტან შედარებით.[54]
მაღალი ხარისხის ციტოლოგიური ნაცხები აუცილებელია დიაგნოსტირებისათვის და ტექნიკურად ადეკვატური უნდა იყოს კარგად მომზადებული უჯრედული მასალითა და კოლოიდით, რათა კვლევამ დამაკმაყოფილებელი შედეგი გამოიღოს. ასპირაციური ბიოფსიით მიღებული მასალის ციტიპათოლოგიის შედეგე შესაძლოა იყოს არადამაკმაყოფილებელი, კეთილთვისებიანი, საშუალო, საეჭვო ან ავთვისებიანი. ციტოლოგიური შედეგების დაახლოებით 10-20 % არადამაკმაყოფილებელი ან არადეკვატურია, 60-75% კეთილთვისებიანია, 6-10% საეჭვო ან ავთვისებიანია.[55][56] ზუსტი ტერმინოლოგია ვარირებს პათოლოგიის დეპარტამენტებს შორის. აღნიშნულმა გამოიწვია Bethesda-ს კლასიფიკაციის სისტემის შემუშავება, რომელიც ჩვეულებრივ გამოიყენება. ის განახლდა 2017 წელს. Bethesda-ს კლასიფიკაციის სისტემა მოიცავს რეკომენდებულ დიაგნოსტიკურ კატეგორიებს, ავთვისებიანობის სავარაუდო რისკს და რეკომენდებულ კლინიკურ მართვას. კატეგორიები განსაზღვრულია, როგორც: არადიაგნოსტირებული ან არადამაკამყოფილებელი; კეთილთვისებიანი; დაუდგენელი მნიშვნელობის ატიპია ან დაუდგენელი მნიშვნელობის ფოლიკულური დაზიანება; ფოლიკულური ნეოპლაზმა ან საეჭვო ფოლიკულურ ნეოპლაზმაზე; საეჭვო ავთვისებიან მდგომარეობაზე ან ავთვისებიან სიმსივნეზე.[57] პრაქტიკაში მართვა შეიძლება დამოკიდებული იყოს სხვა (მაგ., კლინიკურ, სონოგრაფიულ) ფაქტორებზე და არა მხოლოდ წვრილნემსიანი ასპირაციული (FNA) ბიოფსიის ინტერპრეტაციაზე.[57][58]
არადამაკმაყოფილებელი ციტოლოგიური შედეგები განაპირობებს ბიოფსიის გამეორებას. ულტრაბგერით მართული ასპირაციული ბიოფსიის მეორე მცდელობა მოგვცემს დამაკმაყოფილებელ სადიაგნოსტიკო ნიმუშს მკვრივი კვანძები 75%-ში და კისტური კვანძების 50%-ში.[59] თუ 2 მცდელობის შემდეგ შედეგები კვლავ არადამაკმაყოფილებელია, განსახილველია დაკვირვება ან დიაგნოსტიკური ლობექტომია (ჰემითიროიდექტომია).
ასპირაციული ბიოფსიის დროს ციტოლოგიურად კეთილთვისებიან, არა-კისტოზურ დაზიანებებს შესაძლოა ჯერ კიდევ ქონდეთ ავთვისებიანობის 5%-იანი რისკი, რაც შეიძლება უფრო მაღალი იყოს ≥4 სმ კვანძებში (შესაძლოა ცდომილება ნიმუშის არების დროს). ასეთი კვანძები კვლავ საჭიროებს დაკვირვებას კისრის ყოველწლიური გასინჯვით და ულტრაბგერითი კვლევით.[60]
ცისტების შიგთავსის ასპირაცია ხშირად გვაძლევს ციტოლოგიურ შედეგებს, რომლებიც არაადეკვატური ან განუსაზღვრელია უჯრედული შიგთავსისა და კოლოიდის არარსებობის გამო. ცისტური კვანძების უმრავლესობა კომპლექსურია (მკვრივი-ცისტური). სუფთა კისტები არ საჭიროებს ასპირაციულ ბიოფსიას, თუ დიმტომური არ არის, რადგანაც ავთვისებიანობის რისკი ძალიან დაბალია, მაგრამ თუ სუფტა კისტიდან აღებულია არადამაკმაყოფილებელი ან განუსაზღვრელი ასპირატი, მას შესაძლოა ვუმკურნალოთ კონსერვატიულად და შემდგომი ჩარევა არ არის აუცილებელი.
ბეთეზდას კრიტერიუმების მიხედვით კვანძების ციტოლოგიური კვლევით უცნობი მნიშვნელობის ატიპიის (AUS)/უცნობი მნიშვნელობის ფოლიკულური დაზიანების ან მისი ექვივალენტის დიაგნოზი განაპირობებს განმეორებით ასპირაციულ ბიოფსიას 4-6 კვირის შემდგომ, რათა დრო მივცეთ წინა ბიოფსიის ტრაქტის შეხორცებისათვის.[61] პაცაინტები, რომლებსაც აქვთ ფოლიკულური ნეოპლაზიები, და რომლებში ვეჭვობთ ავთვისებიან მდგოამრეობას ან ციტოლოგიამ მოგვცა ავთვისებიანი მდგომარეობის დასკვნა, უნდა გაიგზავნონ გამოცდილ ენდოკრინოლოგთან ან თავისა და კისრის ქირურგთან შემდგომი მკურნალობისთვის.
კლასიფიკაციის სისტემები ასევე ხელმისაწვდომია ამერიკის ფარისებრი ჯირკვლის ასოციაციიდან და ბრიტანეთის ფარისებრი ჯირკვლის ასოციაციიდან და ბეთეზდას კატეგორიების რუკიდან.[1][62]
მოლეკულური მარკერების გამოყენება ასპირაციულ ბიოფსიასთან ერთად
კარგად აღწერილი წერტილოვანი მუტაციები, როგორიცაა BRAF V600E, NRAS61, HRAS61, KRAS12/13, and RET/PTC და PAX8/PPARγ გადაწყობა, დაკავშირებულია ფარისებრი ჯირკვლის კიბოსთან. ასპირაციული ბიოფსიის ნიმუშების ინტერპრეტაციისთვის მოლეკულური კვლევის გამოყენება ზრდის დიაგნოსტიკურ სიზუსტეს და ციტოლოგიური შედეგების სარგებლიანობას.[63]
მოლეკულური ტესტირება, ხელმისაწვდომობის შემთხვევაში, განსაკუთრებით სარგებლიანია შუალედური ციტოლოგიური შედეგების შესაფასებლად, როდესაც ზემოთაღნიშნული მუტაციებიდან ან სტრუქტურის შეცვლიდან (გადაწყობიდან) ერთ-ერთი მნიშვნელოვნად ზრდის ავთვისებიანი მდგომარეობის ალბათობას.[57][64] მოლეკულური ტესტის დადებითმა შედეგმა შესაძლოა შეცვალოს სამედიცინო გადაწყვეტილების მიღება წინა ზედა თიროიდექტომიის, როგორც მკურნალობის ყველაზე შესაფერისი არჩევნის სასარგებლოდ. თუმცა მიუხედავად იმისა, რომ ფარისებრი ჯირკვლის პაპილარული და ფოლიკულური კიბოს უმეტესი ნაწილი შეიცავს ამ მუტაციებს, მათი არარსებობა არ გამორიცხავს ავთვისებიან მდგომარეობას.[1]თუ მოლეკულური ტესტირება არ არის ხელმისაწვდომი, სტანდარტული დიაგნოსტიკური მიდგომა, როგორც წესი, მოიცავს დიაგნოსტიკურ ლობექტომიას (ჰემითიროიდექტომიას), ციტოლოგიურად ორაზროვანი ან დაუდგენელი შემთხვევების გადასაჭრელად.
ქირურგიული დიაგნოსტირება
დიაგნოსტიკური ლობექტომია (ჰემითირეოიდექტომია) უნდა განიხილებოდეს დასკვნითი ჰისტოლოგიური დიაგნოზისთვის, ორი ან მეტი არადამაკმაყოფილებელი ან განუსაზღვრელი წვრილნემსიანი ასპირაციული (FNA) ბიოფსიის შემდეგ; ამ პაციენტებს აქვთ ავთვისებიანი მდგომარეობების განვითარების უფრო მაღალი რისკი, ფარისებრი ჯირკვლის ყველა კვანძის საერთო სიხშირესთან შედარებით.[1] ტოტალური თიროიდექტომია რეკომენდებულია ზოგიერთი პაციენტისთვის, ავთვისებიანი მდგომარეობის ციტოლოგიით, რაც დამოკიდებულია დაზიანების ზომაზე, ლიმფადენოპათიაზე, პოსტოპერაციულად რადიოიოდის მოსალოდნელ საჭიროებასა და ფარისებრი ჯირკვლის სხვა თანარსებულ კვანძოვან დაავადებაზე.[1]
ციტოლოგიურად დაუდგენელი ან საეჭვო შედეგების მქონე კვანძები,ოპტიმალური შემდეგი ნაბიჯების განსაზღვრისთვის საჭიროებს ქირურგისა და ენდოკრინოლოგის მიერ მულტიდისციპლინურ შეფასებას.
ქირურგიული ჩარევა ნაჩვენებია ასევე იმ შემთხვევაშიც, როცა კვანძი იწვევს სიმპტომების განვითარებას ახლომდებარე სტრუქტურებზე (როგორიცაა, ტრაქეასა ან საყლაპავზე) ზეწოლის გამო. CT, MRI და სპირომეტრია შესაძლოა ინფორმატიული დამატებითი მეთოდი იყოს ზეწოლის ხარისხის შესაფასებლად. რეკომენდებულია 4 სმ ან უფრო მეტი ზომის კვანძების მოცილება, რადგან ავთვისებიანობის გამოვლენისთვის წვრილნემსიანი ასპირაციული (FNA) ბიოფსიის ცრუ უარყოფითი სიხშირე ფიქსირდება 13%-მდე ამონარჩევის შეცდომის ხარჯზე.[65] თუმცა, ასპირაციული ბიოფსია მაინც სარგებლიანია დიდი კვანძების შესაფასებლად, რადგანაც ავთვისებიანი მდგომარეობის ან საეჭვო ციტოლოგიის პრეოპერაციული დადასტურება საშუალებას იძლევა, ოპტიმალურად დაიგეგმოს ოპერაციული ჩარევის მასშტაბი.
ყველა პაციენტს, რომელსაც უკეთდება ოპერაცია ფარისებრ ჯირკვალზე, უნდა შეუმოწმდეს ხმა; ხორხის პრეოპერაციული გამოკვლევა რეკომენდებულია პაციენტებისთვის, რომლებსაც პრეოპერაციულად დარღვევები აქვს ხმის მხრივ.[1][Figure caption and citation for the preceding image starts]: ფარისებრ ჯირკვალში წარმონაქმნის გამოკვლევის ალგორითმიშექმნილია BMJ ცოდნის ცენტრისა და Dr. BC Stack Jr- ის მიერ (FNA, ასპირაციული ბიოფსია; PTH, პარათჰორმონი; TSH, ფარისებრი ჯირკვლის მასტიმულირებელი ჰორმონი) [Citation ends].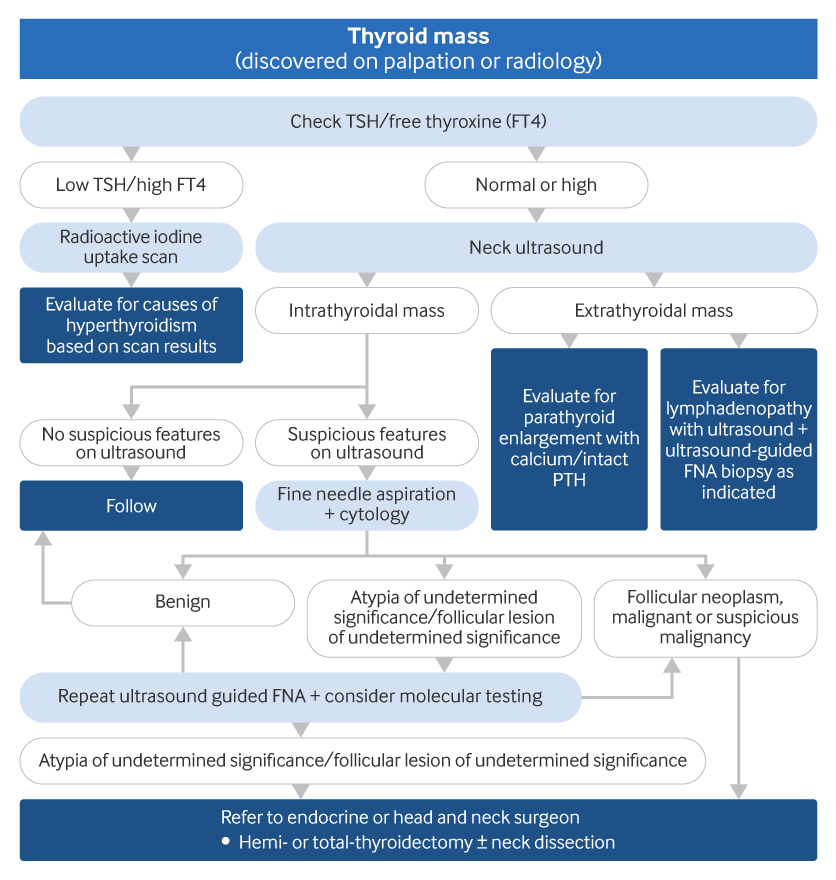
რისკის დაყოფა
ფარისებრი ჯირკვლის კვანძების მქონე პაციენტების რისკის ჯგუფებად დაყოფა, რაც ავთვისებიანი მდგომარეობის ციტოლოგიური დიაგნოზით სრულდება, მეტად მნიშვნელოვანია ფარისებრი ჯირკვლის კიბოს მკურნალობის გასაგებად.[1][18][66] აღნიშნულის მიღწევა შესაძლებელია წინასაოპერაციო ვიზუალიზაციური კვლევით ან ოპერაციის შემდგომი პათოლოგიური კვლევის დამატებითი მონაცემებით.[45] ფარისებრი ჯირკვლის კიბოს მქონე პაციენტებში ეს მეთოდი არის სიფხიზლის დონის და ქირურგიული რეზექციის ან აბლაციის მასშტაბის დადგენის ობიექტური საშუალება. აღნიშნული წარმოდგენილია ცნობილი რისკების მზარდი მასშტაბის სახით.
ამ მასალის გამოყენება ექვემდებარება ჩვენს განცხადებას