Abordaje
El aumento de la percepción pública del cáncer de mama ha resultado en una cantidad importante de mujeres que acuden al médico por presentar masas palpables. Los cánceres de mama que se detectan clínicamente o mediante autoexploración de la mama suelen estar en una etapa más avanzada.[31] Puede realizarse una evaluación adicional mediante ultrasonografía de las masas que se identifican al realizar una mamografía, a fin de determinar si son quísticas o sólidas. El cribado mediante mamografía ha resultado en un mayor número de casos de cáncer de mama que se detectan cuando la masa está en una etapa no palpable.[32][33]
Antecedentes
La mediana de edad al momento del diagnóstico de cáncer de mama en mujeres es de 63 años.[34] Más de la mitad de los cánceres de mama son esporádicos (es decir, en pacientes que no poseen antecedentes familiares de cáncer de mama).
Aproximadamente entre el 5% y el 10% de todos los cánceres de mama se diagnostican en pacientes con una mutación en los genes BRCA-1 o BRCA-2.[35] Las variantes patógenas en BRCA-1 y BRCA-2 se relacionan con un riesgo alto de cáncer de mama, con odds ratios de 7.62 (IC del 95%, 5.33 a 11.27) y 5.23 (IC del 95%, 4.09 a 6.77), respectivamente.[36] Las mutaciones BRCA-1 y BRCA-2 son más frecuentes en mujeres con antecedentes familiares de: cáncer de mama antes de los 50 años, cáncer de mama bilateral, cáncer de mama y ovario en el mismo familiar, cáncer de mama masculino, múltiples casos de cáncer de mama en la familia, uno o más miembros de la familia con 2 tipos primarios de cáncer relacionados con el BRCA (p. ej. cáncer de ovario) y la ascendencia judía asquenazi.[37] Por lo tanto, los antecedentes familiares deben incluir a todos los miembros de la familia con cáncer, la localización del cáncer primario, si el pariente afectado tuvo varios cánceres primarios, la edad en el momento del diagnóstico, la edad en el momento de la muerte y el sexo. US Preventive Services Task Force. BRCA-related cancer: risk assessment, genetic counselling and genetic testing. 2019 Opens in new window
El hecho de poseer anamnesis de hiperplasia atípica antes de la biopsia conlleva un aumento de entre cuatro y cinco veces de riesgo de desarrollar cáncer de mama.[38][39] En el caso de pacientes con anamnesis de carcinoma lobular in situ (CLIS), el riesgo aumenta entre siete y 12 veces.[40] En pacientes con diagnóstico de cáncer invasivo, existe riesgo de padecer cáncer de mama contralateral, que se calcula entre el 0.5% y el 1% anual, acumulativo a lo largo de toda la vida.[40]
En mujeres posmenopáusicas, el tratamiento hormonal sustitutivo con un estrógeno en solitario se asocia con poco o ningún cambio en el riesgo de cáncer de mama.[41] Un estrógeno prescrito en combinación con una progestina se asocia con un aumento en la incidencia de cáncer de mama.[41][42][43][44][45][46]
Existe una asociación entre el aumento de la densidad mamaria (categorizado por el Breast Imaging Reporting and Data System [BI-RADS]) y la incidencia de cáncer de mama en mujeres mayores de 65 años; sin embargo, los mecanismos que subyacen a la asociación observada aún no están claros.[47]
Exploración física
Los hallazgos obtenidos en la exploración física solamente, no bastan para establecer de forma definitiva si una masa es benigna o maligna. No obstante, si se detectan masas fijas e irregulares existe sospecha de neoplasia maligna.[48] Es posible que las lesiones malignas también estén relacionadas con un engrosamiento de la piel (p. ej., piel de naranja) o con cambios en el pezón.[3] Se debe realizar una exploración mamaria bilateral completa que incluya la valoración de las axilas y los ganglios linfáticos regionales en búsqueda de:[49]
Variación del tamaño de la mama[Figure caption and citation for the preceding image starts]: Paciente con cáncer de mama inflamatorio cuya manifestación inicial era una reducción de la mamaCortesía del Dr. Anees Chagpar [Citation ends].
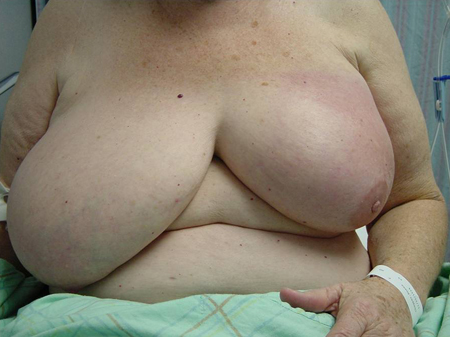
Masas fungoides[Figure caption and citation for the preceding image starts]: Masa evidente con afectación cutánea en mama derechaCortesía del Dr. Anees Chagpar [Citation ends].
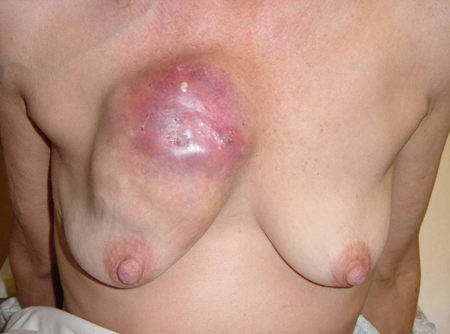 [Figure caption and citation for the preceding image starts]: Masa evidente con afectación cutánea en mama izquierdaCortesía del Dr. Anees Chagpar [Citation ends].
[Figure caption and citation for the preceding image starts]: Masa evidente con afectación cutánea en mama izquierdaCortesía del Dr. Anees Chagpar [Citation ends].
Umbilicación o retracción de la piel[Figure caption and citation for the preceding image starts]: Paciente con masa de gran tamaño en la mama y retracción en la posición de las 6 en mama izquierda, notoria al levantar los brazosCortesía del Dr. Anees Chagpar [Citation ends].

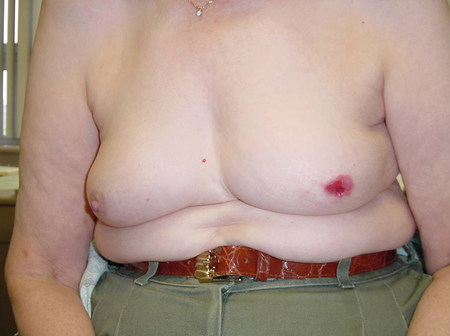
Inversión o excoriación del pezón (hallazgo tradicional en casos de enfermedad de Paget de la mama).[Figure caption and citation for the preceding image starts]: Excoriación del pezón en paciente con enfermedad de Paget de mamaCortesía del Dr. Anees Chagpar [Citation ends].
Estos hallazgos se pueden ver acentuados si se le solicita al paciente estirar los brazos por encima de su cabeza. De forma similar, si se le solicita al paciente colocar las manos sobre las caderas y que apriete hacia adentro mientras flexiona los músculos pectorales, se puede observar afectación de la pared torácica.
Se deben evaluar también los ganglios linfáticos que drenan en las fosas cervical, supraclavicular e infraclavicular. La exploración integral requiere la evaluación de la paciente en posición sentada en posición erguida y en posición supina, ya que a menudo las masas se pueden apreciar mejor en una posición que en la otra.
En un ensayo aleatorizado controlado se observó que al estimular la recogida de documentación fruto de la exploración física mediante un formulario específico, el resultado era una mayor tasa de evaluaciones adicionales sobre masas en la mama y una mejoría de la tasa de detección de cáncer.[50] Estos resultados sugieren que una exploración física específica, puede dar como resultado una mejoría del rendimiento.
Mamografía
Las guías de práctica clínica estadounidenses recomiendan que a todas las mujeres ≥30 años que presenten una masa en la mama se les realice una mamografía diagnóstica (con proyecciones adicionales como la proyección con compresión localizada, la proyección magnificada o la proyección tangencial) y una tomosíntesis digital mamaria (o mamografía con contraste, si está disponible) además de una ecografía.[19][51]Debe referenciarse si se trata de una enfermedad multifocal o multicéntrica.
En el contexto de una masa palpable en la mama, la sensibilidad de la mamografía oscila entre el 82% y el 94% y su especificidad entre el 55% y el 84% en la detección de cáncer de mama.[52][53][54][55]
En mujeres <30 años con una masa palpable en la mama y hallazgos en la ecografía que sean sospechosos de malignidad, las guías de práctica clínica estadounidenses recomiendan la mamografía y la tomografía digital de la mama como estudios de imagen posteriores.[19][51]
Las guías de práctica clínica del Reino Unido recomiendan que las mujeres ≥30 años con un nódulo mamario inexplicable reciban derivación urgente a un especialista en mama para que diagnostique o descarte un cáncer en los 28 días siguientes a la derivación.[56] En mujeres <30 años con un bulto en la mama inexplicable, las guías de práctica clínica recomiendan considerar una derivación no urgente.[56]
Los radiólogos a menudo caracterizan los hallazgos en la ecografía o la mamografía según el BI-RADS.[57][58] Algunos han propuesto registrar la densidad de la mama y el uso de tratamiento hormonal, ya que afectan de forma significativa en la realización de la mamografía.[59][60][Figure caption and citation for the preceding image starts]: Criterios del sistema Breast Imaging Reporting and Data System (BI-RADS)Cortesía del Dr. Anees Chagpar [Citation ends].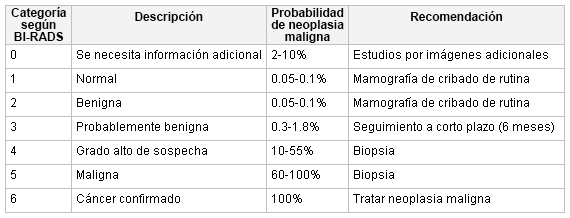 [Figure caption and citation for the preceding image starts]: Mamografía de cribado en la que se observa una masa en la mamaCortesía de la Dra. Nancy Pile, University of Louisville; utilizada con autorización [Citation ends].
[Figure caption and citation for the preceding image starts]: Mamografía de cribado en la que se observa una masa en la mamaCortesía de la Dra. Nancy Pile, University of Louisville; utilizada con autorización [Citation ends].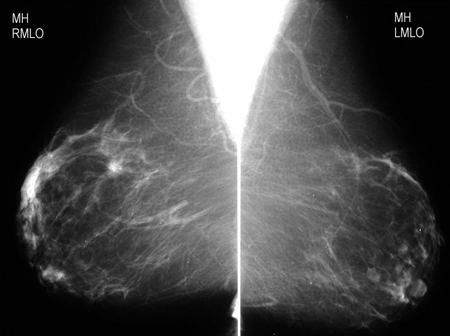 [Figure caption and citation for the preceding image starts]: Imagen aumentada en la que se observa una masa espiculada irregular con calcificaciones asociadasCortesía de la Dra. Nancy Pile, University of Louisville; utilizada con autorización [Citation ends].
[Figure caption and citation for the preceding image starts]: Imagen aumentada en la que se observa una masa espiculada irregular con calcificaciones asociadasCortesía de la Dra. Nancy Pile, University of Louisville; utilizada con autorización [Citation ends].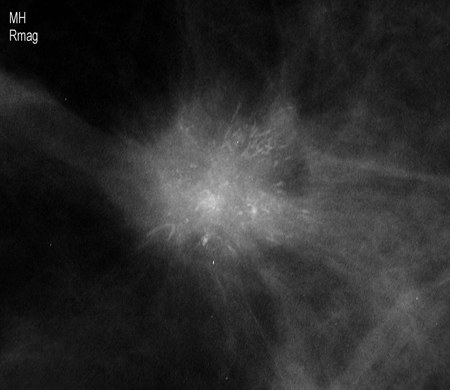
El American College of Radiologists desarrolló el sistema BIRADS como un estándar de comparación para clasificar las mamografías y las imágenes de la mama obtenidas mediante ultrasonido de mama.[58] Establece una clasificación según el grado de sospecha (LOS, por sus siglas en inglés) de la posibilidad de un cáncer de mama. Una puntuación de 1 a 2 permite a la paciente reanudar el cribado habitual; una puntuación de 3 puede requerir otros estudios de imagen mediante mamografía y/o ecografía, o un seguimiento a corto plazo; una puntuación de 4 a 5 requiere una biopsia del tejido.[19][58] Un estudio de imagen negativo de una masa palpable también requiere un seguimiento quirúrgico. Solo se otorga una puntuación de 6 después de haber examinado una biopsia y de haber establecido que se trata de tejido neoplásico, en cuyo caso requiere tratamiento.[58]
Ultrasonido de la mama
A menudo se considera la ecografía como la prueba diagnóstica inicial de elección para pacientes de <30 años de edad, puesto que la densidad del tejido mamario en mujeres más jóvenes limita la sensibilidad de la mamografía.[3][51][61][62] Se ha notificado una tasa de falsos negativos en las mamografías de hasta el 52% en pacientes <35 años de edad con una masa en la mama maligna y palpable.[63]
La ecografía se suele realizar además de la mamografía en la evaluación de las mujeres mayores con sospecha de cáncer de mama.[19][64] La ecografía puede utilizarse como prueba diagnóstica inicial en mujeres de 30 a 39 años cuando se sospeche un quiste simple y el riesgo de cáncer de mama sea bajo.[19]
La ecografía está disponible de forma rutinaria en el ámbito ambulatorio y es una extensión de la exploración física. El American College of Radiology ha publicado guías de práctica clínica que pueden ayudar a los médicos en la realización del ultrasonido de mama.[61][65]
Mediante ultrasonido puede identificarse el carácter simple o complejo de la arquitectura de los quistes.[51] Los quistes simples son lesiones con contenido líquido que se manifiestan como lisos, redondeados, bien delimitados y anecoicos. Si los quistes no presentan tabicaciones ni restos internos, se puede simplemente realizar un seguimiento de los mismos. La ecografía no es capaz de detectar microcalcificaciones en la mama.[Figure caption and citation for the preceding image starts]: Imagen en ultrasonografía de un quiste simpleCortesía del Dr. Lane Roland, University of Louisville; utilizada con autorización [Citation ends].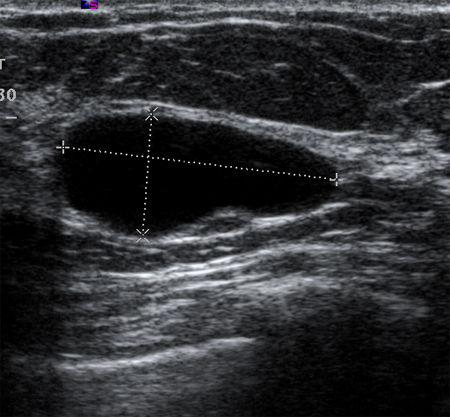
El manejo sugerido para pacientes en los que se detectan masas "probablemente benignas" al realizar un ultrasonido de mama incluye:[19]
Se requiere observación si la sospecha clínica es baja, con exploración física e imagen con ecografía o mamografía a los 6, 12 y 24 meses, para documentar la estabilidad.
Biopsia con aguja gruesa para establecer un diagnóstico definitivo dejando la lesión sigue in situ. Si el resultado es benigno y concordante, se recomienda una exploración clínica de la mama cada 6 a 12 meses, con o sin ultrasonido o mamografía durante 1 año, para evaluar la estabilidad.
Extirpación quirúrgica de la masa, en especial si la lesión es molesta para el paciente.
También puede realizarse una ultrasonografía de la axila a fin de evaluar la linfadenopatía y realizar una biopsia de ganglios linfáticos anómalos.[Figure caption and citation for the preceding image starts]: Algoritmo con valor diagnóstico para ultrasonido de mamaCortesía del Dr. Anees Chagpar [Citation ends].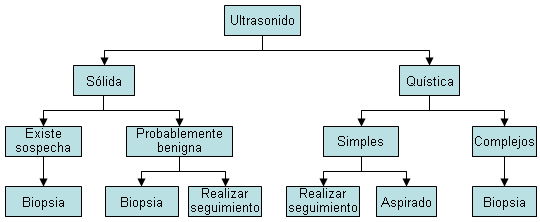
Resonancia magnética (IRM) de la mama
Las guías de práctica clínica de la National Comprehensive Cancer Network (NCCN) recomiendan considerar la IRM con y sin contraste en el estudio de un cáncer de mama inflamatorio si una paciente presenta cambios en la piel compatibles con una enfermedad mamaria grave, y se encuentra en la categoría 1-3 de BIRADS, o en la categoría 4-5 de BIRADS y ha presentado una biopsia con aguja gruesa benigna.[19] La resonancia magnética también puede utilizarse para evaluar una secreción del pezón sospechosa sin una masa palpable si los hallazgos de la mamografía y la ecografía son BIRADS 1-3.[19]
La European Society of Medical Oncology recomienda la resonancia magnética de la mama para investigar la sospecha de cáncer de mama si existen dudas de diagnóstico tras la ecografía y la mamografía.[64]
El Grupo de Trabajo de Servicios Preventivos de los Estados Unidos concluye que no hay pruebas suficientes para determinar el equilibrio entre los beneficios y los perjuicios de las pruebas de detección complementarias para el cáncer de mama con resonancia magnética (o con ecografía mamaria) en mujeres identificadas con mamas densas en una mamografía de detección negativa.[66]
El American College of Radiology no recomienda la IRM en la evaluación inicial de una paciente con una masa mamaria.[51]
En el caso de pacientes que se someten a una IRM, las imágenes ponderadas en difusión pueden ser mejores que las IRM con contraste, a la hora de diferenciar las lesiones benignas de las lesiones malignas.[67] La biopsia está indicada para cualquier lesión sospechosa en la IRM.
Aspiración y biopsia de mama
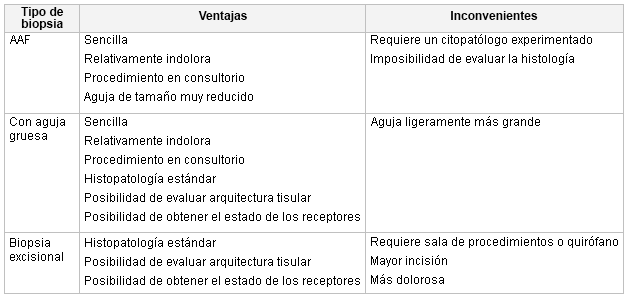
Para establecer un diagnóstico definitivo de cáncer de mama es necesario realizar una biopsia de la mama. Con frecuencia se realizan tres tipos principales de biopsia.
Aspiración con aguja fina (AAF): consiste en colocar una aguja de calibre 22 a 25 en la masa de la mama y extraer células. El hecho de aumentar la cantidad de pasadas aumenta el odds ratio de la AAF para el diagnóstico.[68] Posteriormente, se pueden colocar las células en un portaobjetos o introducirlas en un bloque celular. Las ventajas de la aspiración con aguja fina (AAF) son la rapidez y la facilidad con que se realiza y el hecho de que puede llevarse a cabo en el entorno clínico. Los inconvenientes son que no puede observarse la arquitectura histológica y no puede ayudar a diferenciar un carcinoma ductal in situ de una neoplasia maligna invasiva. Sin embargo, en manos de un citopatólogo experimentado, esta técnica puede ayudar a distinguir las lesiones benignas de las malignas y es valiosa para evaluar los ganglios linfáticos axilares.[68][69]
Biopsia con aguja gruesa: utilizando una aguja de calibre 8 a 14, proporciona una muestra con una cantidad superior de tejido que la aspiración con aguja fina (AAF). Puede realizarse mediante palpación, control estereotáctico o mediante orientación con ultrasonido. Esta técnica se puede realizar en la clínica, es relativamente rápida y sencilla de realizar y permite establecer un diagnóstico histológico. En el caso de un diagnóstico maligno, se pueden realizar estudios de los receptores de hormonas en muestras de biopsia con aguja. Pueden utilizarse diferentes dispositivos para obtener dichas muestras, algunos emplean asistencia con vacío, otros emplean energía por radiofrecuencia.[70][71] En general, la biopsia con aguja gruesa es el método de elección para el diagnóstico histológico de masas en la mama.[72]
Biopsia excisional: consiste en la extirpación de toda la masa en la mama para establecer un diagnóstico histológico preciso. En el caso de una masa asintomática benigna puede que esta técnica invasiva no sea necesaria y en el caso de una masa maligna, no puede obviarse la necesidad de realizar un segundo procedimiento para tratar el cáncer una vez establecido el diagnóstico. Si se obtienen hallazgos de hiperplasia atípica o cicatrices radiales tras una biopsia con aguja, debe realizarse una biopsia excisional para descartar una neoplasia maligna concomitante.[Figure caption and citation for the preceding image starts]: Técnicas de biopsia mamaria (AAF: aspiración con aguja fina)Cortesía del Dr. Anees Chagpar [Citation ends].
Quistes dolorosos
Se puede aspirar bajo orientación ecográfica. El líquido quístico aspirado no debe enviarse para su estudio citológico, ya que generalmente no se identifican las células malignas, a excepción del líquido quístico sanguinolento.[73]
Los quistes que vuelven a aparecer o que no se resuelven por completo mediante aspiración deben someterse a biopsia para descartar una neoplasia maligna. De forma similar, debe plantearse la posibilidad de realizar una biopsia en casos de quistes complejos o que posean elementos sólidos. Las características sonográficas pueden clasificar una masa sólida como "probablemente benigna" o "sospechosa". Las masas que son lisas, ovaladas, lobuladas, con márgenes claramente definidos y cuyo ancho es superior a su altura suelen ser benignas (p. ej., fibroadenoma). Si una masa es irregular, heterogénea, posee márgenes mal definidos o espiculados y su altura supera a su ancho, se considera "sospechosa" de neoplasia maligna y debe realizarse una biopsia.[Figure caption and citation for the preceding image starts]: Imagen en ultrasonografía de un quiste complejoCortesía del Dr. Lane Roland, University of Louisville; utilizada con autorización [Citation ends]. [Figure caption and citation for the preceding image starts]: Imagen en ultrasonografía de un fibroadenomaCortesía del Dr. Lane Roland, University of Louisville; utilizada con autorización [Citation ends].
[Figure caption and citation for the preceding image starts]: Imagen en ultrasonografía de un fibroadenomaCortesía del Dr. Lane Roland, University of Louisville; utilizada con autorización [Citation ends].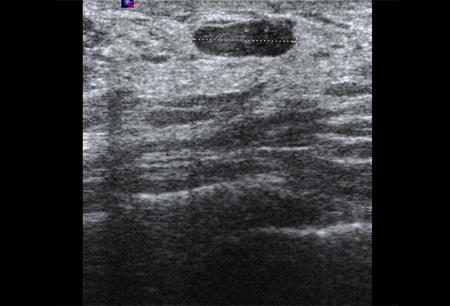 [Figure caption and citation for the preceding image starts]: Imagen en ultrasonografía de un carcinoma invasivoCortesía del Dr. Lane Roland, University of Louisville; utilizada con autorización [Citation ends].
[Figure caption and citation for the preceding image starts]: Imagen en ultrasonografía de un carcinoma invasivoCortesía del Dr. Lane Roland, University of Louisville; utilizada con autorización [Citation ends].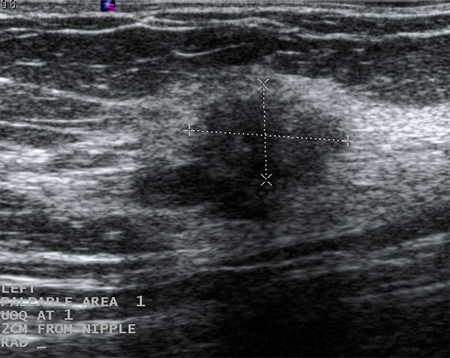
El uso de este contenido está sujeto a nuestra cláusula de exención de responsabilidad